
科目: 来源: 题型:
【题目】汽车尾气中NO产生的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:

A. 温度T下,该反应的平衡常数K=![]()
B. 温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的条件改变可能是加入了催化剂
D. 若曲线b对应的条件改变是温度,可判断该反应的△H<0
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,将4molA和3molB充入体积为1L的密闭容器中,发生如下反应:aA(g)+2B(g)![]() 3C(g)+D(g)。反应达到平衡后,C的浓度为3mol/L.压缩容器体积,使容器的体积减小一半,建立新的平衡时,B的浓度为2mol/L.则方程式中a的数值为
3C(g)+D(g)。反应达到平衡后,C的浓度为3mol/L.压缩容器体积,使容器的体积减小一半,建立新的平衡时,B的浓度为2mol/L.则方程式中a的数值为
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室欲配制1mol/LNaOH溶液240mL,请回答:
(1)需称取NaOH固体_____g,用质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小_______(填字母),并在下图中选出能正确表示游码位置的选项_________(填字母)。

(2)选用的主要玻璃仪器除烧杯、玻璃棒外还有_________________。
(3)下列操作的顺序是(用序号表示)_________________。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需的NaOH的质量,加入少量水,用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(4)下列情况对所配制的NaOH溶液浓度有何影响?(用“偏大”“偏小”“无影响”填写)
①容量瓶用蒸馏洗涤后残留有少量的水________________。
②将热的溶液直接移入了容量瓶________________。
③定容时,仰视容量瓶的刻度线________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用电解饱和食盐水生产氯气(Cl2)、烧碱和氢气的化学方程式是2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑。
2NaOH+Cl2↑+H2↑。
(1)电解食盐水的过程中,氧化产物是____________________,用双线桥表示出电子转移的方向和数目________________,题干中反应改写成离子方程式是_____________。
(2)实验室用______________溶液(填化学式)处理多余的氯气,避免污染环境,写出化学方程式___________________________________________________。
(3)电解食盐水要求对粗食盐水进行精制,以除去粗食盐水中含有的泥沙和SO42-、Ca2+、Mg2+等杂质离子。精制时依次加入BaCl2溶液、Na2CO3、NaOH,充分反应后过滤,在滤液中加入盐酸中和至中性。盐酸与滤液反应的离子方程式__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在体积固定的密闭容器中进行,达到平衡状态的标志是
2NO+O2在体积固定的密闭容器中进行,达到平衡状态的标志是
①单位时间内生成nmolO2的同时消耗2nmolNO2
②单位时间内生成nmolO2的同时消耗2nmolNO
③用NO2、NO、O2表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A. ②④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目: 来源: 题型:
【题目】大量排放氮的氧化物会产生酸雨、光化学烟雾等环境问题。工业上处理氮的氧化物途径有多种:
Ⅰ.碱吸祛。利用纯碱溶液吸收NO、NO2,发生的反应有:
2NO2+Na2CO3=NaNO3+NaNO2+CO2,NO+NO2+Na2CO3=2NaNO2+CO2
用一定量纯碱溶被吸收NO、NO2恰好完全反应得到吸收溶液。
(1)向吸收溶液中滴加酸性高锰酸钾溶液,溶液褪色,氧化产物为NO3-,写出离子方程式__________
Ⅱ.天然气还原法。
CH4催化还原NO、NO2的热化学方程式如下:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574k]/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH2=-1160kJ/mol
(2)4NO(g)=N2(g)+2NO2(g)ΔH=_________
(3)上述物质NaNO2、NO、CO2中含有共同的化学键的类型是_______
Ⅲ.活性炭还原法。
在VL恒容密闭容器中加入足量的活性炭和一定量NO,恒温(T1)条件下发生反应生成Q、P(均为无污染物质)。测得物质的量与时间关系如表所示:
n/mol t/min | NO | Q | P |
0 | 0.200 | 0 | 0 |
10 | 0.116 | 0.042 | 0.042 |
20 | 0.080 | 0.060 | 0.060 |
30 | 0.080 | 0.060 | 0.060 |
(4)在T1温度下,NO的平衡转化率为_______;平衡常数K为_________(用分数表示)。
(5)30min后,将温度升高至T2达到平衡时,容器中NO、Q、P的浓度之比为3:1:1,则该反应的正反应ΔH_____0(填“>”“<”或“=”)。在T2温度达到平衡之后,再向容器中充入少量NO,则NO的平衡转化率将_____________“变大”“不变”“变小”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】碲(Te)位于元素周期表第ⅥA族,该元素组成的物质可用作石油裂化的催化剂、电镀液的光亮剂、玻璃的着色材料及合金材料的添加剂等。精炼铜的阳极混含有Cu2Te、Au、Ag等,利用下列工艺流程可回收碲:
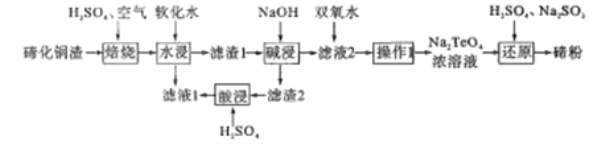
已知:TeO2熔点733℃,微溶于水,可溶于强酸和强碱。回答下列问题:
(1)Te与S的简单氢化物的稳定性强弱顺序为:__________(用氢化物的化学式表示)。
(2)“焙烧”的化学方程式__________(碲主要以TeO2形式存在)。
(3)“焙烧”后的固体用软化水“水浸”,该过程的有效物质的浸出率及浸出速率对该工艺流程很重要,写出两条提高“水浸”速率的措施:________。“滤液1”的溶质有________。
(4)“滤渣1”进行“碱浸”的目的是________
(5)“滤液2”加入双氧水,能否改用氯水或氯气,说明原因:_________
(6)“还原”制备碲粉的氧化产物是_________
(7)从环境保护和资源合理开发的可持续发展意识和绿色化学观念来看,分析“滤渣2”进行“酸浸”的意义:________
查看答案和解析>>
科目: 来源: 题型:
【题目】 下列事实不能用勒夏特列原理解释的是 ( )
A.合成氨工业上增大压强以提高反应物的转化率
B.黄绿色的氯水光照后颜色变浅
C.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
D.在含有Fe(SCN)2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com