
科目: 来源: 题型:
【题目】化合物E 是合成一种眼科表面麻醉用药的中间体,其合成路线如下:

(1)E 中的含氧官能团名称为硝基、_________、____________(写两种)。
(2)D→E 的反应类型为________________________。
(3)反应A→B 的化学方程式为_________________________。从整个流程看,设计A→B 这一步的目的是________________________________________。
(4)D 有多种同分异构体,同时满足下列条件的D 的同分异构体(不含立体异构)有____种,其中属于a氨基酸的同分异构体的结构简式为_________________________。(不写立体异构)。
①分子中同时含有苯环、醛基、羧基和氨基,且分子中有一个手性碳原子;②分子中有6 种不同化学环境的氢;③不能与FeCl3溶液发生显色反应。
(5)请以![]() 和C2H5OH 为有机原料制备医药中间体(
和C2H5OH 为有机原料制备医药中间体(![]() ),写出制备的合成路线流程图( 无机试剂任用,合成路线流程图示例见本题题干)。______________________
),写出制备的合成路线流程图( 无机试剂任用,合成路线流程图示例见本题题干)。______________________
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某学生用0.1500 mol/L NaOH溶液测定某未知浓度的盐酸溶液,其操作可分解为如下几步:
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸25.00 mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是(用序号字母填写):____→ → F → → → → D。
(2)操作F中应该选择图中滴定管_____(填标号)。

(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察_____。
(4)滴定结果如表所示:
滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 0.60 | 20.60 |
3 | 25.00 | 0.20 | 20.19 |
计算该盐酸的物质的量浓度为_____(精确至0.0001)。
(5)下列操作会导致测定结果偏高的是_____。
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(6)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0﹣4 mol/L的KMnO4溶液。
Ⅰ、写出用KMn04滴定H2C2O4的离子方程式_____________________。
Ⅱ、判断滴定终点的方法是________________________。
Ⅲ、计算:血液中含钙离子的浓度为_____mol/L。
查看答案和解析>>
科目: 来源: 题型:
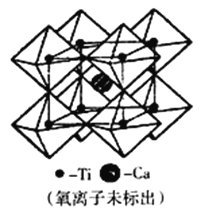
【题目】钛被称为继铁、铝之后的第三金属,在工业上有着广泛而重要的用途。
(1)基态钛原子的价电子排布图为__________________;基态铝原子核外电子分布在____个能级上。
(2)许多金属及其化合物灼烧时会产生特征焰色,产生焰色的原因是______________________。
(3)FeCl3熔点306℃、沸点315℃,CaCl2熔点782℃、沸点1600℃,同是金属氯化物,熔沸点差别很大的原因是________________________________。
(4)煅烧铁矿石常会生成SO2,SO2为_______分子(填“极性”或“非极性”);分子中的大π键可用符号Пnm表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为П66)。推测SO2分子中的大π键可表示为_______________。
(5)钙钛矿可用来冶炼钛,它的晶胞结构如图所示。钛离子位于立方晶胞的角顶,被____个氧离子包围成配位八面体;钙离子离子位于立方晶胞的体心,被_____个氧离子包围。钙钛矿晶体的化学式为________________________。若该晶胞的边长为apm,则钙钛矿晶体的密度为_____________g·cm-3(用NA表示阿保加德罗常数的值,只要求列算式,不必计算出数值)
查看答案和解析>>
科目: 来源: 题型:
【题目】反应C(s)+H2O(g)==CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变能使反应速率加快的是
A. 增加C的量
B. 保持体积不变,充入N2使体系压强增大
C. 将容器的体积缩小一半
D. 保持压强不变,充入N2使容器体积增大
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生对Na2SO3与AgNO3在不同pH下的反应进行探究,过程如下:
(1)调节pH,实验记录如下:
实验 | pH | 现象 |
a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
I.Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
II.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是____________________________。
②推测a中白色沉淀为Ag2SO4,推测的依据是_________________________________。
(2)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于_________溶液中,未溶解。
(3)将X从溶液中滤出、洗净,为确认其组成,实验如下:
I.向X中滴加稀盐酸,无明显变化
II.向X中加入过量浓HNO3,产生红棕色气体
III.用Ba(NO3)2溶液、BaCl2溶液检验II中反应后的溶液,前者无变化,后者产生白色沉淀
①实验I的目的是_________________________。
②根据上述现象,分析X的性质和元素组成是__________________________。
③II中反应的化学方程式是________________________。
(4)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,SO32-还原性增强,并通过进一步实验确认了这种可能性,实验装置如图所示:

①气体Y是__________________。
②白色沉淀转化为X的化学方程式是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1=90.7 kJ·mol1
CH3OH(g) △H1=90.7 kJ·mol1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=23.5 kJ·mol1
CH3OCH3(g)+H2O(g) △H2=23.5 kJ·mol1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=41.2 kJ·mol1
CO2(g)+H2(g) △H3=41.2 kJ·mol1
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=___________kJ·mol1。
CH3OCH3(g)+CO2(g)的△H=___________kJ·mol1。
(2)反应②达平衡后采取下列措施,能提高CH3OCH3产率的有___________。
A.加入CH3OH B.升高温度 C.增大压强 D.移出H2O E.使用催化剂
(3)以下说法能说明反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)达到平衡状态的有___________。
CH3OCH3(g)+CO2(g)达到平衡状态的有___________。
A.H2和CO2的浓度之比为3∶1
B.单位时间内断裂3个H—H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(4)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示:
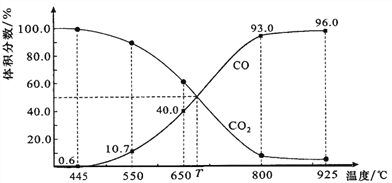
已知:气体分压(p分)=气体总压(p总)×体积分数。
①该反应△H_____0(填“>”、“<”或“=”),550 ℃时,平衡后若充入惰性气体,平衡__________(填“正移”、“逆移”或“不移动”)。
②650 ℃时,反应达平衡后CO2的转化率为_____________(保留2位有效数字)。
③T时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=_________p总。
查看答案和解析>>
科目: 来源: 题型:
【题目】将a mol钠和a mol铝一同投入V L足量的水中,所得溶液的物质的量浓度为(假设反应前后溶液体积不变)
A. a/V mol/L B. 1000a/V mol/L C. a/2V mol/L D. a/1000V mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:

①写出电极反应式:正极__________________________ ;负极_________________________。
②图中X溶液是_______________,Y溶液是__________________。
③原电池工作时,盐桥中的________(填“阳”或“阴”)离子向X溶液方向移动。
(2)如图是一个化学过程的示意图。

①甲池中OH-移向__________极(填“CH3OH”或“O2”)。
②写出通入CH3OH的电极的电极反应式_______________。
③乙池中总反应的离子方程式___________________。
④当乙池中B(A g)极的质量增加5.40g,若此时乙池中溶液的体积为500ml,则溶液的pH是___________;此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是______________(填序号)。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com