
科目: 来源: 题型:
【题目】铁的化合物在生产生活和科学实验中应用广泛:
(1)一定条件下Fe2O3与甲烷反应制取纳米级铁,同时生成CO和H2。已知:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-27.6kJ/mol
CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.4kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.0kJ/mol
①反应Fe2O3(s)+3CH4(g)![]() 2Fe(s)+3CO(g)+6H2(g)的△H=________。
2Fe(s)+3CO(g)+6H2(g)的△H=________。
②若该反应在5L的密闭容器中进行,5min后达到平衡,测得体系中固体质量减少0.96g,则该段时间内CO的平均反应速率为________。
③若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是________(选填序号)。
a.c(CH2)=c(CO) b.固体的总质量不变
c.v(CO)与v(H2)的比值不变 d.混合气体的平均相对分子质量不变
④该反应的化学平衡常数的负对数pK随反应温度T的变化曲线如下图。

试用平衡移动原理解释该曲线的变化规律________________。若700℃时测得平衡时,H2浓度为1.0mol·L-1,则CH4的平衡转化率为_________。
(2)菱铁矿的主要成分是FeCO3,实验室中可以通过FeSO4与足量NaHCO3溶液混合制得FeCO3,有关反应的离子方程式为________________________。已知Ksp[FeCO3]=3.2×10-11,H2CO3的Ka1=4.30×10-7,Ka2=5.61×10-11。试通过以上数据简要计算说明该反应能进行的原因_______________________________。
(3)Na2FeO4是一种高效净水剂,工业上以Fe为阳极,NaOH为电解质溶液进行电解制备,写出阳极的电极反应式_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学利用如图所示的实验装置进行铁与水蒸气的实验,并研究铁及其化合物的部分性质。

请回答下列问题:
(1)硬质试管中发生反应的化学方程式为______________________。
(2)该同学为确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色,则说明硬质试管的固体物质中一定有____,可能有____;若溶液未变红色,则说明硬质试管中固体物质的成分是____________________。
(3)该同学按(2)中所述实验方案进行了实验,结果溶液未变红色,原因是___________(用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其与NaOH溶液反应。若按下图所示操作,可观察到试管中先生成白色沉淀,后沉淀迅速变成灰绿色,最后变成红褐色的现象,请写出白色沉淀变为红褐色的过程中所发生反应的化学方程式:______________________________。

(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+具有____________性。由此可知,实验室中含有Fe2+的盐溶液需现用现配制的原因是____________________,并且配制含Fe2+的盐溶液时应加入少量____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应A(g)+B(g) ![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
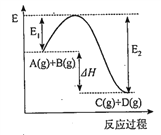
(1)该反应是___________反应(填“吸热”或“放热”)。
(2)△H=_______________。
(3)反应体系中加入催化剂对反应热是否有影响?___________________(填“有影响”“无影响”)。
(4)升高温度,该反应的平衡常数K将_________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。

(1)X与Y所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,X离子的数目为 。
②该化合物的化学式为 。
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是 。
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是 。
(4)Y 与Z 可形成YZ42-
①YZ42-的空间构型为 。
②写出一种与YZ42-互为等电子体的分子的化学式: 。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】二甲醚(CH3OCH3)被称为21世纪的新型燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
化学反应方程式 | 化学平衡常数 | |
①CO(g)+2H2(g) | ΔH1=-99 kJmol-1 | K1 |
②2CH3OH(g) | ΔH2=-24 kJmol-1 | K2 |
③CO(g)+H2O(g) | ΔH3=-41 kJmol-1 | K3 |
(1)该工艺的总反应为3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g) ΔH
CH3OCH3(g)+CO2(g) ΔH
该反应ΔH=__________________,化学平衡常数K=____________________(用含K1、K2、K3的代数式表示)。
(2)某温度下,将8.0molH2和4.0molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则CO的转化率为________。
CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则CO的转化率为________。
(3)下列措施中,能提高CH3OCH3产率的有________。
A.分离出二甲醚 B.升高温度 C.改用高效催化剂 D.增大压强
(4)该工艺中反应③的发生提高了CH3OCH3的产率,原因是_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Cu3N具有良好的电学和光学性能,在电子工业领城、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的作用。
(1)Cu+的核外电子排布式为__________;N元素与O元素的第一电离能比较:N____O(填“>”、“<”或“=”)。
(2)与N3-含有相同电子数的四原子分子的空间构型为____________________。
(3)在Cu催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中醛其(![]() )碳原子的杂化方式为_________。
)碳原子的杂化方式为_________。
(4)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被C1-取代可生成Cu(H2O)2Cl2,试画出其具有极性的分子的结构式________________。
(5)Cu3N的晶胞结构如图所示,N3-的配位数为________;若晶胞棱长为anm,NA表示阿伏加德罗常数的值,则Cu3N的密度p=______g/cm3 [用含a 和NA 的式子表示,Mr(Cu3N)=206]

查看答案和解析>>
科目: 来源: 题型:
【题目】氰气的分子式为(CN)2,结构式为N![]() C-C
C-C![]() N,性质与卤素相似,下列叙述正确的是
N,性质与卤素相似,下列叙述正确的是
A. 分子中四原子共直线,是非极性分子 B. N![]() C 键的键长大于C
C 键的键长大于C![]() C键的键长
C键的键长
C. 分子中含有2个σ键和4个π键 D. 氰气不和氢氧化钠溶液发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com