
科目: 来源: 题型:
【题目】甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,依次通过的洗气瓶中盛放的试剂最好为( )
A.澄清石灰水、浓硫酸B.KMnO4酸性溶液、浓硫酸
C.溴水、浓硫酸D.浓硫酸、KMnO4酸性溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】氨氯地平可用于治疗高血压和心绞痛。其中间体F的合成路线流程图如下:
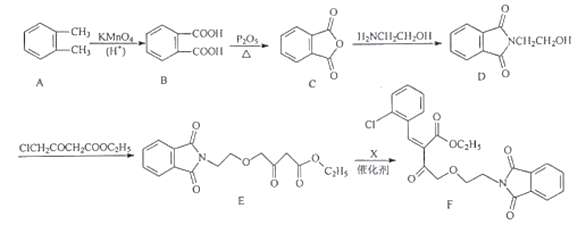
(1)F中的含氧官能团名称为酰胺键、________和________等。
(2)D![]() E的反应类型为___________
E的反应类型为___________
(3)X的分子式为C7H5Ocl,写出X的结构简式:___________
(4)写出同时满足下列条件的E的一种同分异构体的结构简式:___________
①含两个苯环的α-氨基酸②能与FeCl3溶液发生显色反应③分子中只有5种不同化学环境的氢
(5)已知:CH3CH2CN![]() CH3CH2COOH。请写出以CH3CH2OH、NCCH2CN、
CH3CH2COOH。请写出以CH3CH2OH、NCCH2CN、![]() 为原料制备
为原料制备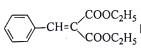 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验能达到预期目的的是
序号 | 实验内容 | 实验目的 |
A | 将FeCl3固体溶于少量浓盐酸中,再加蒸馏水稀释至所需浓度 | 配制氯化铁溶液 |
B | 常温下,将干电池的温度升高到40℃,其输出电流增大 | 证明干电池可将环境热能转化为电能 |
C | 向CuCl2溶液中加入NaOH调节pH>4 | 除去CuCl2的Fe3+杂质 |
D | 向BaSO4悬浊液中加入Na2CO3饱和溶液,过滤出的沉淀加入盐酸有气体生成 | 证明Ksp(BaCO3)<Ksp(BaSO4) |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】K2Cr2O7是一种重要的化工原料。以铬铁矿(主要成分为FeO·Cr2O3,还含有Al2O3、Fe2O3等杂质)为原料制备K2Cr2O7的一种工艺流程如下:
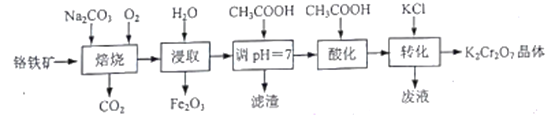
已知:
①4FeO·Cr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②Cr2O72-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
(1)“焙烧”时,Al2O3与Na2CO3发生反应的化学方程式为___________。
(2)“滤渣”的主要成分是________(填化学式).
(3)“酸化”步骤调节溶液pH<5,其目的是_________
(4)“转化”一步发生反应的化学方程式为____________
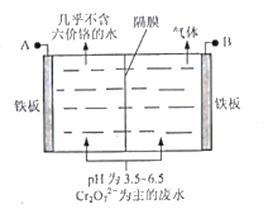
(5)采用电解法处理含铬废水原理如下图所示。阳极区溶液中发生反应:Cr2O72-+6Fe2++14H+ == 2Cr3+ +6Fe3+ + 7H2O,阳极的电极反应式为_______,阴极产生的气体为_______(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液的物质的量浓度的计算正确的是
A. 标准状况下,a L NH3溶于1000 g水中,得到的溶液密度为b gcm-3,(考虑溶液体积变化)则该溶液的物质的量浓度为![]() molL-1
molL-1
B. 将100 mL 1.5 molL-1的NaCl溶液与200 mL 2.5 molL-1的NaCl溶液混合(忽略溶液体积变化),得到溶液的物质的量浓度为2 molL-1
C. V L Fe2(SO4)3溶液中含Fe3+m g,溶液中c(SO42-)是![]() molL-1
molL-1
D. 某温度时,饱和NaCl溶液的密度为ρ gcm-3,物质的量浓度为cmol/L,该溶液中NaCl的质量分数为![]() ×100%
×100%
查看答案和解析>>
科目: 来源: 题型:
【题目】某固体A在一定条件下可完全分解,生成B、C、D三种气体的混合物。反应方程式如下:2A=B↑+2C↑+3D↑,此时测得混合气体的相对平均分子质量为30,则固体A的相对原子质量为
A. 180g/mol B. 90g/mol C. 90 D. 180
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组采用刻蚀废液(主要含CuCl2、FeCl3、FeCl2、HCl)制取Cu和Cu2Cl2,实验流程如下:
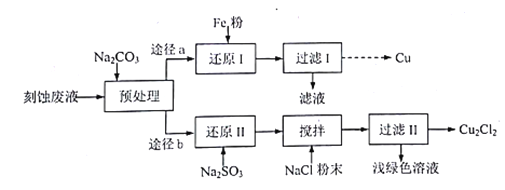
已知:Cu2Cl2是白色固体,微溶于水,难溶于乙醇,受潮后在空气中易被迅速氧化。
(1)“预处理"时,需用Na2CO3调节溶被至微酸性而不是碱性,其原因是_____
(2)“还原Ⅰ”需在80℃条件下进行,适宜的加热方式为_______
(3)“还原Ⅱ”中,Cu2+参与反应的离子方程式为______
(4)“搅拌”时加入NaCl粉末的作用是________
(5)“过滤Ⅱ”得到的Cu2Cl2需用无水乙醇洗涤,并在真空干燥机内于70℃干燥2小时,冷却,密封包装。于70℃真空干燥的目的是_________
(6)①请设计从“过滤Ⅰ”所得滤渣中获取Cu的实验方案:_______(实验中可供选择的试剂:稀硫酸、稀硝酸、蒸馏水)。
②现欲测定途径a、b回收铜元素的回收率比,请补充实验方案:_______________,分别按途径a、b制取Cu和Cu2Cl2,测得Cu的质量为m1g,Cu2Cl2的质量为m2g,则途径a、b铜素的回收率比为________(铜元素回收率=产品中铜元素质量/废液中铜元素的质量×100%)
查看答案和解析>>
科目: 来源: 题型:
【题目】微生物电池工作原理如图所示。下列有关说法错误的是
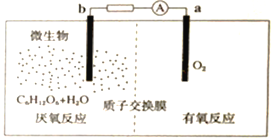
A. 外电路的电流方向是由a到b
B. 正极的电极反应为:O2+4e-+4H+=2H2O
C. 1molC6H12O6完全反应生成CO2,转移24mol电子
D. 反应一段时间后,电池内部的氢离子物质的量减少
查看答案和解析>>
科目: 来源: 题型:
【题目】某氯原子的质量为a g,12C原子的质量为b g,用NA表示阿伏加德罗常数的值,下列不正确的是
A. 该氯原子的摩尔质量为![]() g/mol B. x g该氯原子的物质的量是
g/mol B. x g该氯原子的物质的量是![]() mol
mol
C. 1 mol该氯原子的质量是aNA g D. y g该氯原子所含的原子数为![]() NA
NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com