
科目: 来源: 题型:
【题目】实验表明钠离子聚合物新型电池正负极材料均表现出较快的电极反应动力学,使得电池表现出类似电容器的高功率性能。可以循环充放电高达50000次,这远远超过了传统可充电电池的循环寿命(<10000次)。其放电时的工作原理如图。下列说法不正确的是
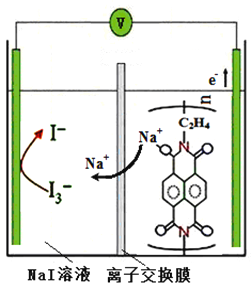
A. 充电时,阳极的电极反应式为3I--2e-=I3-
B. 离子交换膜只能让阳离子通过而不能让阴离子通过
C. 放电时,当转移0.5mol电子时,NaI溶液中增加NA个Na+
D. 放电时,高聚物发生氧化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】H2C2O4(乙二酸),俗名草酸,存在于自然界的植物中。已知常温下草酸电离平衡常数K1=5.0×10-2,K2=5.4×10-5,碳酸的电离平衡常数K1=4.5×10-7,K2=4.7×10-11。Ksp (CaC2O4)=2.3×10-9,Ksp(CaCO3)=2.5×10-9。回答下列问题:
(1)写出草酸溶液中存在的主要电离反应方程式_____________________________________。
(2)长期将豆腐与菠菜混合食用,容易损失钙素且患胆结石疾病。理由是______________________。
(3)25℃,物质的量浓度均为0.1mol/L 的Na2C2O4溶液的pH比Na2CO3溶液pH_________(填“大”“ 小”或“相等”)。将上述两种溶液等体积混合后,滴加CaCl2溶液,当C2O42- 沉淀完全时,CO32-是否沉淀完全_______________(填“是”或“否”)
(4)写出NaHC2O4溶液中水解反应的离子方程式________________________________,计算常温下该反应的水解平衡常数为_____________________,NaHC2O4溶液的pH____7 (填“>”、“<”或“=”)
(5)向盛有饱和草酸溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液的紫红色褪去,写出该反应的离子方程式________________________________________。
(6)设计实验证明草酸的酸性比碳酸强________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁元素在电化学中应用广泛。回答下列问题:
(1)根据反应2Fe3++Cu==2Fe2++Cu2+设计原电池如图。电流计显示电流方向为:a→b。

①电极B为____________,电解质溶液C为_____________。(填标号)
A,碳棒 B.铜片 C.Fe2(SO4)3溶液 D.CUSO4溶液
②A电极的电极反应式为________________________________________。
③用该电池做电源,电解硫酸钠溶液,当电解池阳极有11.2mL气体(标准状况)产生时,该电池有__________________molFe3+被还原。
(2)NaFeO4是一种用途广泛的化工产品,工业上常用电解法制取。制取装置如图。已知Na2FeO4只在强碱性条件下比较稳定,具有强氧化性。

①Na2FeO4中铁元素化合价为_____________ Na2FeO4是具有杀菌效果的净水剂。原因是_________________________________________________。
②电极Ni为_________________(填“阳”或“阴”)极。为使该装置能持续反应,离子交换膜应为__________________________(填“阳”或“阴”)离子交换膜。
③阳极反应式为_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用一只长滴管,深入液面下,向盛有FeCl2溶液的试管中滴加NaOH溶液,可观察到有白色沉淀生成.生成白色沉淀的离子方程式 , 在空气中放置的现象是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在一密闭容器中充入a mol NO和b mol O2,可发生如下反应:2NO+O2 = 2NO2,充分反应后容器中氮原子和氧原子的个数之比为________。
(2)某强氧化剂RO4- 能将Na2SO3氧化成Na2SO4,已知含2.0×103 mol RO4- 离子的溶液,恰好跟25.0 mL 0.2 mol/L 的Na2SO3溶液完全反应,则反应后R的化合价为_______价。
(3)按体积比为1∶2∶3所组成的N2、O2、CO2的混合气体100g,在标准状况下的体积为_____L。
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:

(1)指出提取碘的过程中有关的实验操作名称:①_________③_________
(2)操作③中所用的有机试剂可以是CCl4,简述选择理由_________________________________。
(3)操作过程③包括如下几步:
A.检验分液漏斗活塞和上口的玻璃塞是否漏液; B.把盛有溶液的分液漏斗放在铁架台的铁圈中; C.把50 mL碘水和15 mL有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞; D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正; E.静置、分层; F.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准; G.旋开活塞,用烧杯接收溶液; H.从分液漏斗上口倒出上层液体。
a.上述F步操作的目的是:_____________________________
b.最后碘的CCl4溶液是通过_____________________获得(填“漏斗上口”或“漏斗下口”)。
(4)从含碘的有机溶液中提取碘和回收有机溶液CCl4,还需要经过蒸馏,观察下图所示实验装置,指出仪器名称b__________,冷却水从____进入(填A或B),最后碘留在_________________里。(填仪器名称)

查看答案和解析>>
科目: 来源: 题型:
【题目】实验室探究SO2与Fe(NO3)3溶液反应的原理,装置如下图,实验中Y装置产生白色沉淀。下列说法不正确的是

A. 滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2
B. Y中产生的白色沉淀是BaSO4或BaSO3
C. 产生白色沉淀的原因可能是在酸性条件下SO2与NO3- 反应生成了SO42-
D. 若将Fe(NO3)3换成FeCl3,Y中也能产生白色沉淀,说明Fe3+也能将SO2氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】自来水中氯离子的测定对人体健康有重要意义,实验室常用莫尔法测定水体中氯离子含量。实验过程如下:向水样中加入K2CrO4 (黄色) 溶液作指示剂,用AgNO3溶液滴定至终点。已知:Ag2CrO4为不溶于水的砖红色沉淀;常温下Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)= 1.8×10-12。
回答下列问题:
(1)滴定时,应使用____________(填“酸式”或“碱式”) 滴定管,原因是_______________________。
(2)水样应调至中性或弱碱性,强酸性时加入K2CrO4溶液发生反应的离子方程式是___________________________________________。
(3)滴定达到终点的标志是___________________________________________。
(4)实验过程中测得数据如下表:
编号 | 1 | 2 | 3 |
V(水样)/mL | 10.00 | 10.00 | 10.00 |
c(AgNO3)/ mol·L-1 | 0.0010 | ||
V(AgNO3)/mL | 3.75 | 4.01 | 3.99 |
计算水样中氯离子的含量为_______________mg/L(保留2位小数)
(5)滴定结束后:
①当溶液中的残余c(Cl-)=1.8×10-5mol/L,则此时溶液中c(CrO42-)=____________。
②已知2AgCl+ CrO42-![]() 2Cl-+Ag2CrO4,计算出该反应的平衡常数为____________。
2Cl-+Ag2CrO4,计算出该反应的平衡常数为____________。
(6)下列情况会造成实验测定结果偏低的是____________。(填标号)
A.锥形瓶洗涤后未干燥
B.滴定前,未使用标准液润洗滴定管
C.酸式滴定管滴定前仰视读数,滴定后俯视读数
D.酸式滴定管滴定前尖嘴部分充满溶液,滴定结束时滴定管尖嘴有气泡
查看答案和解析>>
科目: 来源: 题型:
【题目】镁与稀硝酸的反应为:4Mg+10HNO3(稀)=4Mg(NO3)2+NH4NO3+3H2O
(1)用“双线桥法”表示该反应中电子转移的方向和数目__________。
(2)该反应中,Mg发生了__________反应,氧化剂与还原剂的物质的量之比为__________________。
(3)还原产物是_________,HNO3表现了__________________。
(4)若反应过程中转移的电子数为1.505×1023,则参加反应的Mg的质量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com