
科目: 来源: 题型:
【题目】以下是由苯乙烯为原料合成有机高分子化合物M的一种合成路线(部分反应条件及副产物已略去):

已知:I.RCHBr-CH2Br![]() RC≡CH
RC≡CH
II.CH≡CH+CH2=CH-CH=CH2![]()
III. 
请回答下列问题:
(1)D的结构简式为______,E的结构简式为________。
(2)C+D→E的反应类型为______,I中含氧官能团的名称为___________。
(3)H+I→M的化学方程式为___________。
(4)在催化剂加热条件下,G与氧气反应生成Q(C9H8O3),同时满足下列条件的Q的同分异构体有_____种(不考虑立体异构),其中核磁共振氢谱有6组吸收峰的结构简式为____。
①除苯环外不含其他环状结构
②能与FeCl3溶液发生显色反应
③能与NaHCO3溶液反应生成CO2
(5)参照上述合成路线和相关信息,以甲醇和一氯环己烷为有机原料(无机试剂任选),设计制备己二酸二甲酯的合成路线_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲烷在镍催化作用下可与水反应制合成气(CO和H2),再制成甲醇代替燃油。
(1)CH4和H2O所含的三种元素电负性从小到大的顺序为________。
(2)CH4和CO2分子中碳原子的杂化类型分别是_____和_______。
(3)基态Ni原子的电子排布式为______,该元素位于元素周期表的第_____族。
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,该分子呈正四面体构型。则1molNi(CO)4中含有____molσ键,Ni(CO)4的晶体类型为_____,Ni(CO)4易溶于下列___(填选项字母)中。
a.水 b.四氧化碳 C.苯 d.硫酸镍溶液
(5)如图是一种镍镧合金储氢后的晶胞结构示意图。该合金中原子个数比La:Ni=_____,储氢后,含1molLa的合金可吸附H2的数目为______。

查看答案和解析>>
科目: 来源: 题型:
【题目】(1)将碳酸钙、稀盐酸、铁、氧气四种物质填写到下面的适当位置。

___________、___________、___________、___________。
(2)从(1)中的四种物质中选出一种或几种为反应物,按下述反应类型,各写一个化学方程式。
①分解反应:_______________________________;
②化合反应:_______________________________;
③置换反应:_______________________________;
④复分解反应:_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用水钴矿[主要成分为Co2O3和Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)提高水钴矿浸出速率的措施有_______________________________________(填写两点),浸出过程中Co2O3发生反应的离子方程式为________________________。
(2)NaClO3的作用是_________________________________。
(3)加Na2CO3调pH至5.2所得沉淀为_________________。
(4)萃取剂对金属离子的萃取率与pH的关系如图。萃取剂的作用是___________________________________________;其使用的适宜pH范围是______________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5

(5)由萃取后余液获得粗产品的操作步骤为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土化合物,汽车尾气用稀土/钯三效催化剂处理,不仅可以降低催化剂的成本,还可以提高催化效能。以氟碳铈矿(主要成分为CeCO3F)为原料制备CeO2的一种工艺流程如下:
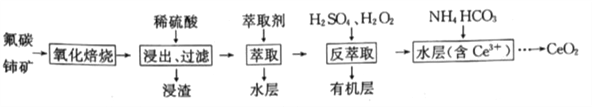
已知i.Ce4+能与F-结合成CeFx(4-x)+,也能与SO42-结合成(CeSO4)2+;
ⅱ.在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取:Ce4++n(HA)2![]() CeH2n-4A2n)+4H+,而Ce3+则不能。
CeH2n-4A2n)+4H+,而Ce3+则不能。
回答下列问题:
(1)CeCO3F中铈元素的化合价为_____,“氧化焙烧”过程中可以加快反应速率的方法是_____(答出两点即可)。
(2)“萃取”时,选用(HA)2作为萃取剂,(HA)2需满足的条件是________;“萃取”后的水层中含有的主要阴离子是________。
(3)“反萃取”时加入H2SO4的作用是__________;加入H2O2的作用是_______(结合离子方程式说明)
(4)浸渣经处理可得Ce(BF4)3,在KCl溶液中加入Ce(BF4)3,发生如下反应:Ce(BF4)3(s)+3K+(aq)![]() 3KBF4(s)+Ce3+(aq)
3KBF4(s)+Ce3+(aq)
一定温度时,Ce(BF4)3、KBF4的Ksp分别为a、b,若上述反应体系中K+的物质的量浓度为cmol/L,则Ce3+的物质的量浓度为______mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】含磷化合物在生产生活中有着重要的应用。
(1)磷与氨是同主族元素,下列能说明者非金属性强弱的是_______(填字母)。
a.NH3比PH3稳定性强
b.常温下,氮气为气体,磷单质为固体
c.氮气与氢气化合比磷与氢气化合更困难
d.HNO3的酸性比HPO3酸性强
(2)工业常用磷精矿[Ca5(PO4)3F]和硫酸反应制各磷酸。己知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) △H=-271kJ/mol
5CaO(s)+3H3PO4(l)+HF(g)=Ca5(PO4)F(s)+5H2O(l) △H=-937kJ/mol
则Ca5(PO4)F和硫酸反应制备磷酸的热化学方程式为________________。
(3)已知PCl5(g)![]() PCl3(g)+Cl2(g)△H>0。温度为T时,把一定量的PCl5气体引入一真空瓶内,反应达平衡后PCl5与PCl3的分压之比为1:3(分压一总压×物质的量分数)。
PCl3(g)+Cl2(g)△H>0。温度为T时,把一定量的PCl5气体引入一真空瓶内,反应达平衡后PCl5与PCl3的分压之比为1:3(分压一总压×物质的量分数)。
①PCl5的分解率a1=_____%。若达到兴衡后体系总压为1.4MPa,用平衡分压代替平衡浓度表示反应的平衡常数Kp=_________。
②温度为T2时,新的平衡体系中PCl5与Cl2分压相同,则PCl5的分解率a1________a2,温度T1___T2(填“>”“<”或“=”)。
③达到平衡后,下列情况使PCl5分解率增大的是___________(填字母)。
a.温度、体积不变,充入氩气 b.体积不变,对体系加热
C.温度、体积不变,充入氯气 d.温度不变,增大容器体积
(4)氧化水解法产三氯氧磷的废水中主要含有H3PO4、H3PO3等,可先加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收。
①在沉淀前先加入适量漂白粉的作用是__________________。
②下图是不同条件对磷的沉淀回收率的影响图像。处理该厂废水需控制的工艺条件为______。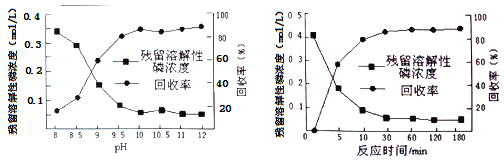
查看答案和解析>>
科目: 来源: 题型:
【题目】根据反应 8NH3 + 3Cl2 = N2 + 6NH4Cl,回答下列问题:
①用双线桥法标出该反应中电子转移的方向和数目:_____.
②该反应中_____元素被还原,_____元素被氧化.
③氧化剂和还原剂的物质的量之比为_____.
④在该反应中,若有 3mol 电子发生转移,在标准状况下,可生成N2的体积为_____L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com