
科目: 来源: 题型:
【题目】关于氢键,下列说法正确的是( )
A. 含氢元素的化合物中一定有氢键
B. 氢键比分子间作用力强,所以它属于化学键
C. DNA中的碱基互补配对是通过氢键来实现的
D. H2O是一种非常稳定的化合物,这是由于氢键所致
查看答案和解析>>
科目: 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+B(g)![]() 2C(g)+D(g)。若最初加入的A和B都是3mol,在前10sA的化学反应速率为0.12mol·L-1·s-1,则10s时,容器中B的物质的量是
2C(g)+D(g)。若最初加入的A和B都是3mol,在前10sA的化学反应速率为0.12mol·L-1·s-1,则10s时,容器中B的物质的量是
A. 0.6mol B. 1.2mol C. 1.8mol D. 2.4mol
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是实验室研究潜水艇中供氧体系反应机理的装置图(夹持仪器略)。
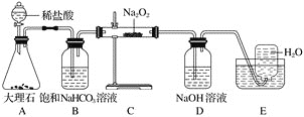
(1)A装置为CO2的发生装置,反应的离子方程式为____________________。
(2)B装置可除去A装置中可能挥发出的___________,反应的离子方程式为_______________。
(3)C装置为O2的发生装置,反应的化学方程式为__________________、________________。
(4)D装置可除去C装置中未反应的__________,反应的离子方程式为____________________。
(5)E装置为排水法收集O2的装置,检验所收集的气体为O2的方法为_____________________。
(6)C装置中固体由淡黄色完全变为白色,检验固体成分的实验方案为取少量C装置中反应后的固体溶于水,向溶液中滴入过量___溶液,若有白色沉淀生成,则证明固体中含有___;过滤,向滤液中滴入几滴酚酞溶液,若__且不褪色,则证明固体中含有__。
查看答案和解析>>
科目: 来源: 题型:
【题目】据报道,1995年我国科研人员在兰州首次合成了镤元素的一种同位素镤-239,并测知其原子核内有148个中子。现有A元素的一种同位素,比镤—239的原子核内少54个质子和100个中子,则A元素在周期表中的位置是
A. 第3周期第ⅠA族 B. 第4周期第ⅠA族
C. 第5周期第ⅠA族 D. 第3周期第ⅡA族
查看答案和解析>>
科目: 来源: 题型:
【题目】美国科学家发现,普通盐水在无线电波的照射下可以燃烧,这一发现将有望解决未来人类的能源危机。无线电频率可以降低盐水中所含原子之间的结合力,释放出氢原子,一旦点火,氢原子就会在这种频率下持续燃烧。上述“结合力”的实质是( )
A.共价键B.离子键C.静电斥力D.静电引力
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,容积为2 L的密闭容器中,将2 mol L气体和3 mol M气体混合,发生如下反应:2L(g)+3M(g)![]() xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
(1)10 s末L的物质的量浓度为_____________。
(2)前10 s内用M表示的化学反应速率为_____________。
(3)化学方程式中x值为_____________。
(4)在恒温恒容条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
(5)在恒温恒压条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
查看答案和解析>>
科目: 来源: 题型:
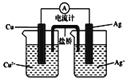
【题目】(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72-的酸性废水通过铁炭混合物,在微电池正极上Cr2O72-转化为Cr3+,其电极反应式为______________________________________。
(2)氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。与汽油相比,氢气作为燃料的优点是_____________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:__________________________________。
(3)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2===Fe+2Li2S,正极反应式是_____________________________。
(4)右图所示原电池正极的反应式为___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙酰基扁桃酰氯是一种医药中间体。 某研究小组以甲苯和乙醇为主要原料,按下列路线合成乙酰基扁桃酰氯。

已知:

(1)甲苯与氯气反应生成 A的条件是________。
(2)物质 B中含有的官能团是________。
(3)物质 D 的结构简式是_________。
(4)下列说法正确的是________。
a.化合物 A不能发生取代反应
b.乙酰基扁桃酰氯属于芳香烃
c.化合物 C 能与新制的 Cu(OH)2发生反应
(5)E+F→G 的化学方程式是_______。
(6)化合物 D 有多种同分异构体,同时符合下列条件的同分异构体共有_______ 种,写出其中两种的同分异构体的结构简式_______。
①红外光谱检测表明分子中含有氰基(-CN);
②1H-NMR 谱检测表明分子中有苯环,且苯环上有两种不同化学环境的氢原子。
(7)设计以乙醇为原料制备 F 的合成路线(用流程图表示;无机试剂任选) _______。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和H2O,放出热量624kJ(25℃时),N2H4完全燃烧的热化学方程式是____________________________________。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%30%的KOH溶液。肼-空气燃料电池放电时:
正极的电极反应式是_________________________;
负极的电极反应式是_________________________。
(3)右图是一个电解过程示意图。
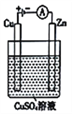
①锌片上发生的电极反应式是______________________。
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化为128g,则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气体积分数为20%)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知某反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答问题。
C(g)+D(g)过程中的能量变化如图所示,回答问题。
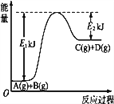
该反应是____(填“吸热”或“放热”)反应,该反应的ΔH=_____ kJ· mol-1(用含E1、E2的代数式表示)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)==2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1
②H2O(l) =H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式___________________________。
(3)已知:H2(g)+Cl2(g)==2HCl(g) ΔH=-185 kJ/mol,断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol Cl—Cl键吸收的能量为247 kJ,则形成1 mol H—Cl键放出的能量为______kJ。
(4)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com