
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 标准状况下,22.4L 氦气与 1mol氢气所含原子数均为 2NA
B. 25 ℃、1.01×105Pa时,2.24 L Cl2中含有的原子数为0.2×6.02×1023
C. 常温常压下,S2和S8的混合物共6.4 g,所含硫原子数一定为0.2 NA
D. 将100 mL 0.1 molL﹣1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.01 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】已知 3.6 g 碳在 6.4 g 的氧气中燃烧,至反应物耗尽,并放出 X kJ 热量。已知单质 C(s)的燃烧热数值为 Y kJ·mol-1,则 1 mol C(s)与 O2(g)反应生成 CO(g)的反应热 ΔH 为( )
A. -Y kJ/mol B. -(10X-Y) kJ/mol C. -(5X-0.5Y) kJ/mol D. +(10X-Y) kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】同温同压下,质量相同的CO2、O2、CH4三种气体,下列说法错误的是
A. 所占的体积由大到小的顺序是:CH4>O2>CO2
B. 所含分子数由多到少的顺序是:CH4>O2>CO2
C. 密度由大到小的顺序是:CO2>O2>CH4
D. 所含的电子数由多到少是:CO2>CH4>O2
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学——选修3:物质结构与性质】已知Fe、HCN与K2CO3在一定条件下发生如下反应:Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:
(1)金属铁的紧密堆积方式为_______________,其配位数为_____________________。
(2)HCN 分子的结构式为___________,与CN-互为等电子体的阴离子是_________________。
(3)K2CO3中阴离子的空间构型为_______________,CO2为_____________分子(填“极性”或“非极性”),H2O中O原子的杂化轨道类型为_______________。
(4)配合物K4Fe(CN)6的中心离子的电子排布式为__________________。
(5)上述化学方程式中C、N、O的第一电离能由小到大的顺序为________________________。
(6)冰的晶体结构模型如图1,它的晶胞与金刚石的晶胞相似,如图2,水分子之间以氢键相连接,在一个晶胞中有_____个氢键,若氢键键长为d nm,则晶体密度(g·cm-3)计算式为___________ (用NA 表示阿伏加德罗常数的值。)
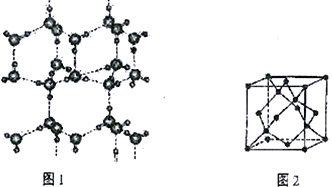
查看答案和解析>>
科目: 来源: 题型:
【题目】密闭容器中,反应aA(g)+bB(g)![]() cC(g)+dD(g)达平衡时,B的浓度为0.6mol/L,若保持温度不变,将容器的容积扩大到原来的3倍,达新平衡时B的浓度降为0.3mol/L.下列判断正确的是
cC(g)+dD(g)达平衡时,B的浓度为0.6mol/L,若保持温度不变,将容器的容积扩大到原来的3倍,达新平衡时B的浓度降为0.3mol/L.下列判断正确的是
A. a+b<c+d
B. 平衡向正反应方向移动
C. D的体积分数减小
D. 达到新平衡时,A、B的浓度减小,C、D浓度增大
查看答案和解析>>
科目: 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%-50%。减少CO2 排放是一项重要课题。
(1)以CO2为原料抽取碳(C)的太阳能工艺如右图所示。
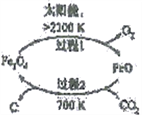
①过程1中每生成1mol FeO转移电子数为____________。
②过程2中发生反应的化学方程式为________________________________。
(2)CO2在新型钴基电催化剂作用下,转化为清洁燃料——甲酸。其工作原理如下图所示,写出生成甲酸的电极反应式:____________。
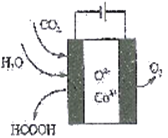
(3)航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用。
Sabatier反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
水电解反应:2H2O(l)![]() 2H2(g)+O2(g)
2H2(g)+O2(g)
将原料气按n(CO2)∶n(H2)=1∶4 置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如下图所示(虚线表示平衡曲线)。
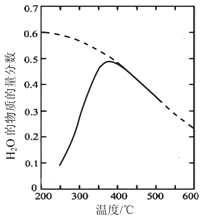
①温度过高或过低均不利于该反应的进行,原因是____________________________________。
②200℃达到平衡时体系的总压强为p,该反应平衡常数的计算式为________________(不必化简,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)一种新的循环利用方案是用Bosch反应CO2(g)+2H2(g)![]() C(s)+2H2O(g)代替Sabatier反应。
C(s)+2H2O(g)代替Sabatier反应。
①已知CO2(g)、H2O(g)的生成焓分别为-394 kJ·mo1-l、-242 kJ·mo1-l,Bosch反应的ΔH=__________ kJ·mo1-l。(生成焓指一定条件下由对应单质生成1mol 化合物时的反应热)
②一定条件下Bosch反应必须在高温下才能启动,原因是______________________________。
③新方案的优点是_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应:①Cl2+2KBr=2KCl+Br2, ②KClO3+6HCl=3Cl2+KCl +3H2O,
③2KBrO3+Cl2=Br2+ 2KClO3,下列说法正确的是
A. 上述三个反应都有单质生成,所以都是置换反应
B. 氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2
C. 反应②中还原剂与氧化剂的物质的量之比为6:1
D. ③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol
查看答案和解析>>
科目: 来源: 题型:
【题目】兰尼镍是一种带有多孔结构的细小晶粒组成的镍铝合金,被广泛用作有机物的氢化反应的催化剂。以红土镍矿(主要成分为NiS、FeS和SiO2等)为原料制备兰尼镍的工艺流程如下图所示:
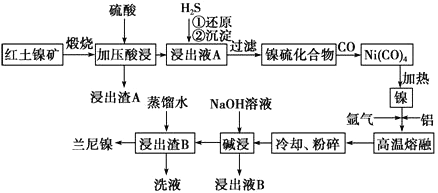
(1)浸出渣A的主要成分是_______________(填化学式)。
(2)已知红土镍矿煅烧后生成Ni2O3,而加压酸浸后浸出液A中含有大量Ni2+,写出有关镍元素的加压酸浸的化学反应方程式_______________________________。
(3)向浸出液A中通入H2S气体,①还原过程中所涉及主要反应的离子方程式是__________________________________。
(4)在形成Ni(CO)4的过程中,碳元素的化合价没有变化,则Ni(CO)4中的Ni的化合价为________。 (5)“碱浸”的目的是使镍产生多孔结构,从而增强对氢气的强吸附性,此过程中发生反应的离子方程式为__________________________。
(6)常温时,向浓度均为1.0mol·L-1的FeSO4、NiSO4的混合溶液中滴加Na2S 固体,当Ni2+恰好沉淀完全时,所得溶液中c(Fe2+)=______________。
(已知:①25℃,Ksp(NiS)=2.0×10-21、Ksp(FeS)=6.0×10-18
②溶液中的离子浓度≤10-5 mol·L-1时,认为该离子沉淀完全。)
(7)浸出液B可以回收,重新生成铝以便循环利用。请设计简单的回收流程:
浸出液B→___________________________________________________________。 (箭头上注明外加反应物的化学式和反应条件)。(示例:![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com