
科目: 来源: 题型:
【题目】将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的是
A. ①③⑤⑦⑧ B. ②④⑦ C. ①⑥ D. ②④⑥⑧
查看答案和解析>>
科目: 来源: 题型:
【题目】Na2O2可用作漂白剂和呼吸面具中的供氧剂
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。
①写出Na2O2作供氧剂的化学反应方程式____________;
②使酚酞溶液变红是因为________,红色褪去的可能原因是___________;
③加入MnO2反应的化学方程式为____________;
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应。为了验证此猜想,该小组同学进行加下实验,实验步骤和现象如下:
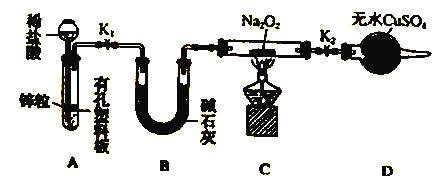
步骤1:按上图组装仪器(图中夹持仪器省略),检查气密性,装入药品。
步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后没有任何现象。
步骤3: ,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色。
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
①添加稀盐酸的仪器名称是______,B装置的作用_________。
②步骤3在点燃C处酒精灯前必须进行的操作是______________;
③装置D的目的是_________;
④你得到的结论是________(若能反应请用化学方程式表示);
⑤该实验设计中存在着明显不足之处,应该如何改进:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是__________________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入__________________。
A.硫酸钾 B.硫酸锰 C.氯化钾 D.水
II. 分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
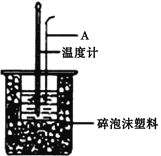
(1)仪器A的名称是__________________,烧杯间填满碎泡沫塑料的作用是__________________。
(2)加入NaOH溶液的正确操作是__________________ (填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g·℃)。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1℃ | 终止温度t2℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H=__________________(结果保留一位小数)。
(4)实验中若改用50 mL 0.50 mol/L的盐酸与40 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量__________________(填“相等”“不相等”),若实验操作均正确,则所求中和热__________________(填“相等”“不相等”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.在一定条件下aA+bB![]() cC+dD达到平衡时,请填写:
cC+dD达到平衡时,请填写:
(1)若A、B、C、D都是气体,在加压后平衡向逆反应方向移动,则a、b、c、d关系是__________________。
(2)已知B、C、D是气体,现增加A的物质的量,平衡不移动,说明A是__________________(填状态)。
(3)若容器容积不变,加入气体B,气体A的转化率__________________(填“增大”“减小”或“不变”)。
(4)若加热后,C的百分含量减小,则正反应是__________________反应(填“放热”或“吸热”)。
(5)若保持容器压强不变,且A、B、C、D都是气体,向容器中充入稀有气体,则化学平衡正向移动,则a、b、c、d关系是__________________。
Ⅱ.工业上一般采用下列反应合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g)。
CH3OH(g)。
(1)在一定温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.5mol·L-1。该反应的平衡常数K=__________________。
(2)若在一体积可变的容器中充入l molCO、 2mol H2和1mol CH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向__________________(填“正”、“逆”)反应方向移动。
(3)若在温度和容积相同的三个密闭容器中,按不同方式投人反应物,测得反应达到平衡吋的有关数据如下表:
容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度(mol/L) | 能量变化(Q1、Q2、Q3均大于0) |
1 | 2molCO和4molH2 | a1% | c1 | 放出Q1kJ热量 |
2 | 2molCH3OH | a2% | c2 | 吸收Q2kJ热量 |
3 | 4molCO和8molH2 | a3% | c3 | 放出Q3kJ热量 |
则下列关系正确的是 __________________。
A. c1=c2 B.2Q1=Q3 C.2a1=a3 D.a1 +a2 =1 E.该反应若生成2mol CH3OH,则放出(Q1+Q2)kJ热量
查看答案和解析>>
科目: 来源: 题型:
【题目】铁不能与冷、热水反应,但能与水蒸气反应。资料显示,在不同温度下,铁粉与水蒸气反应的产物不同,温度低于570 ℃时,生成FeO,高于570 ℃时,生成Fe3O4。某学生用如图所示实验装置,完成还原铁粉与水蒸气反应的实验。

(1)实验中使用肥皂液的作用是____________。
(2)甲同学为探究实验后试管内的固体含有哪些物质,进行 了下列实验:
实验编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管1中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈绿色;有少量气泡产生 |
② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据上述实验,能确定固体中存在的物质有:______________________________;不能确定是否存在Fe3O4的原因是:___________________________________________。
(3)乙同学设计下列实验方案以确定实验后试管内的固体是否存在Fe3O4。

①溶液X中发生氧化还原反应的离子方程式为___________;
②操作a为_______,检验沉淀是否已经洗涤干净的操作是___________________。
(4)丙同学将试管内固体看做铁的氧化物(FexO),取出6.08 g溶于足量盐酸中,向所得溶液中通入448 mLCl2(标准状况),恰好将Fe2+完全氧化。则x=__________。
查看答案和解析>>
科目: 来源: 题型:
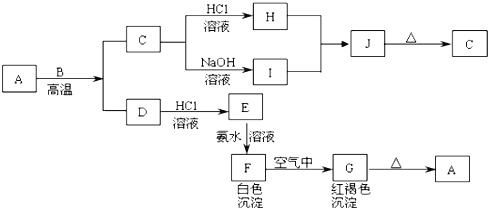
【题目】A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。
请回答下列问题
(1)写出下列物质的化学式A______,E_______,J________,G_______。
(2)F在空气中转化为G的化学方程式:______。
(3)C转化为I的离子方程式:______。
(4)H和I生成J的离子方程式:______。
(5)D在高温下和水蒸气反应的化学方程式:______。
(6)如何检验E中大量存在的阳离子?___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】C、Ti的单质及其化合物在现代社会有广泛用途。
(1)基态钛原子的电子排布式为________。
(2)CS2分子中含有σ键和π键之比为______;NO2+与CO2是等电子体,NO2+的电子式为___,键角为_______。
(3)CH3CHO沸点低于CH3CH2OH的原因是_____;CH3CHO分子中碳原子杂化类型为_____。
(4)钛酸钡(BaTiO3)晶体的某种晶胞如图所示。NA为阿伏加德罗常数值,Ba2+、O2-、Ti4+的半径分别为apm、bpm、cpm。

①与钡离子等距离且最近的氧离子有______个;
②假设晶体中的Ti4+、Ba2+分别与O2-互相接触,则该晶体的密度表达式为______g.cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E为前四周期元素,且原子序数依次增大
A | 第二周期中一种非金属元素,第一电离能大于相邻元素 |
B | 地壳中含量最多的元素,2P轨道上有二个孤电子 |
C | 与B同主族 |
D | 前四周期中金属性最强的元素 |
E | 前四周期中原子核外孤电子数最多 |
(1)C元素位于第__________________周期__________________族,B元素的核外电子排布式为__________________,E元素的价电子排布图为__________________。
(2)B、C两元素的电负性大小关系为:__________________(用元素符号表示),A、B的最简单气态氢化物的稳定性强弱大小关系为:________________(用氢化物的化学式表示)。
(3)B的氢化物由固体变为气态所需克服的微粒间的作用有__________________。
(4)有A、B、C三种元素及氢元素组成的既含离子键又含共价键且其中元素C显最高价的酸式盐的化学式是__________________。
(5)D2B2的电子式为__________________,与CO2反应生成B的单质的化学方程式为:__________________。
(6)E2O72-具有强氧化性,可与含有C元素的某种还原性离子反应(该离子中C元素显+4价),在酸性条件下该反应的离子方程式为:__________________
查看答案和解析>>
科目: 来源: 题型:
【题目】研究NO2、NO、CO污染物处理,对建设美丽中国具有重要意义。
(1)①NO2(g)+CO(g)==CO2(g)+NO(g)△H1=-234.00kJ/mol
②1/2N2(g)+1/2O2(g)=NO(g)△H2=-89.75kJ/mol
③2NO(g)+O2(g)==2NO2(g)△H3=-112.30kJ/mol。
若NO2气体和CO气体反应生成无污染气体,其热化学方程式为______________。
(2)某温度下,向10L密闭容器中分别充入0.1molNO2和0.2molCO,发生反应:2NO2(g)+4CO(g)=N2(g)+4CO2(g),经10min反应达到平衡,容器的压强变为原来的![]() 。
。
①0~10min内,CO的平均反应速率v(CO)=__________;
②若容器中观察到_____,可判断该反应达到平衡状态;
③为增大污染物处理效率,起始最佳投料比为______;
④平衡后,仅将CO、CO2气体浓度分别增加一倍,则平衡_____(填“右移”或“左移”或“不移动”)。

(3)在高效催化剂作用下用NH3还原NO2进行污染物处理。
①相同条件下,选用A、B、C三种催化剂进行反应,生成氮气的物质的量与时间变化如图a。活化能最小的是______(用E(A)、E(B)、E(C)表示三种催化剂下该反应活化能)。
②在催化剂A作用下测得相同时间处理NO2的量与温度关系如图b。试说明图中曲线先增大后减小的原因________(假设该温度范围内催化效率相同)。

(4)有人设想在含有NO2的酸性污水中加人填充有铝粉的多孔活性炭颗粒进行水的净化。试结合电极反应说明多孔活性炭的主要作用_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O![]() +O2+xOH-=Fe3O4↓+S4O
+O2+xOH-=Fe3O4↓+S4O![]() +2H2O。请回答下列问题。
+2H2O。请回答下列问题。
(1)水热法制备Fe3O4纳米颗粒的反应中,还原剂是____________。
(2)反应的化学方程式中x=________。
(3)每生成1 mol Fe3O4,反应转移的电子为________mol,被Fe2+还原的O2的物质的量为________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com