
科目: 来源: 题型:
【题目】二氧化氯是一种安全、高效的消毒剂,实验室制取二氧化氯的化学方程式如下:2NaClO3 + Na2SO3 + H2SO4 ![]() 2ClO2↑+ 2Na2SO4 + H2O。下列有关该反应说法正确的是
2ClO2↑+ 2Na2SO4 + H2O。下列有关该反应说法正确的是
A. NaClO3是还原剂 B. Na2SO3被氧化
C. NaClO3失去电子 D. H2SO4发生还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】以铬酸钾为原料,用电解法制备重铬酸钾的实验装置如图,下列说法不正确的是

A. 在阴极室,发生的电极反应为:2H2O+2e-=2OH-+H2↑
B. 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+ Cr2O72-+H2O向左移动
C. 该制备过程总反应的化学方程式为:4K2CrO4+4H2O![]() 2K2Cr2O4+4KOH+2H2↑+O2↑
2K2Cr2O4+4KOH+2H2↑+O2↑
D. 测定阳极液中K和Cr的含量。若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为2-d
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列叙述正确的是
A. 1mol甲醇中含有C—H键的数目为4NA
B. 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA
C. 标准状况下,2.24L已烷含有分子的数目为0.1NA
D. 常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA
查看答案和解析>>
科目: 来源: 题型:
【题目】狼毒素来自香科植物,具有止痛、杀虫的功效。N是合成狼毒素的重要中间体,其合成路线如下:
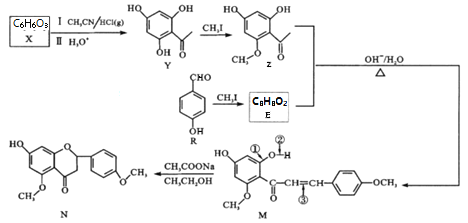
(1)R中含氧官能团名称______;Y→Z的反应类型_______。
(2)1molZ与NaOH溶液反应,最多消耗NaOH为_____mol;反应R→E的化学方程式为_________。
(3)下列能测出N的相对分子质量的仪器是_____(填字母序号)。
A.元素分析仪 B.质谱仪 C.核磁共振仪 D.红外光谱仪
(4)反应M→N中M的断键位置为______(填数字序号)。
(5)同时满足下列条件的Y的同分异构体有_____种。
①苯环上有3个取代基; ②为芳香族化合物且属于酯类;
③遇氯化铁溶液显紫色; ④苯环上一氯代物有2种。
(6)以丙酮和![]() 为原料合成某有机中间体(
为原料合成某有机中间体( ),参照上述路线,设计路线__________________________。
),参照上述路线,设计路线__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某地菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、MgCO3、Al2O3等杂质,工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:
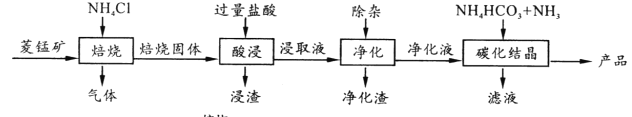
已知:MnCO3+2NH4Cl ![]() MnCl2+CO2↑+2NH3↑+H2O↑
MnCl2+CO2↑+2NH3↑+H2O↑
(1)焙烧时温度对锰浸取率的影响如图。
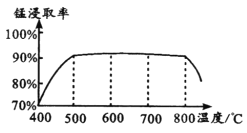
焙烧时适宜温度为_____;800℃以上锰的浸取率偏低,可能原因是________。
(2)净化包含三步: ①加入少量MnO2,反应的离子方程式为___;
②加氨水调pH,生成沉淀主要是_________;
③加入NH4F,除去Ca2+、Mg2+。
(3)碳化结晶中生成MnCO3的离子方程式为___________。
(4)滴定法测产品纯度
I 取固体产品1.160g于烧杯中,加入过量稀H2SO4充分振荡,再加入NaOH溶液至碱性,发生反应2Mn2++O2+4OH-=2MnO(OH)2;
II 加入过量KI溶液和适量稀H2SO4,发生反应:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;
III 取I中混合液的1/10于锥形瓶中,加入淀粉溶液作指示剂,用0.1000mol/LNa2S2O3溶液进行滴定,发生反应:2S2O32-+I2=S4O62-+2I-,滴定终点时消耗Na2S2O3溶液20.00mL。
①判断滴定终点的方法是____________。
②假设杂质不参与反应,则产品纯度为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,不属于氧化还原反应的是
A. 2Na + 2H2O =2NaOH + H2↑ B. 2Na + O2![]() Na2O2
Na2O2
C. 2Na2O2 + 2CO2=2Na2CO3+O2 D. NaHCO3+HCl=NaCl+H2O+CO2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组实验探究葡萄糖、二氧化硫分别与新制氢氧化铜的反应。
实验I新制Cu(OH)2与葡萄糖反应
(1)将1.5mL1.0mol/LCuSO4溶液滴入5mLl.0mol/LNaOH溶液中制得Cu(OH)2悬浊液。相关反应的离子方程式为___________。
(2)在制得的Cu(OH)2悬浊液中加入稍过量葡萄糖溶液,加热煮沸,产生红色沉淀。
①该实验现象说明_______________;
②该原理可用于检测糖尿病患者血液中的______含量。
实验II新制Cu(OH)2与二氧化硫反应
按上述方法重新制取氢氧化铜悬浊液,通入足量二氧化硫,先产生红色沉淀,然后红色沉淀逐渐变为紫红色固体,最终溶液呈无色。
(1)探究红色沉淀转变为紫红色的原因。
将实验I产生的红色沉淀过滤、洗涤,洗涤方法是_____。
将所得固体分成两等份于试管中并加入少量蒸馏水进行对比实验。
实验装置图 |
|
|
操作及现象 | 红色固体很快转变为紫红色固体,溶液呈蓝色。 | 开始红色固体缓慢变为紫红色固体,溶液呈蓝色。试管内紫红色固体逐渐增多,最后溶液变无色。 |
解释及结论 | ①该反应的离子方程式 _________________。 | ②开始时红色固体颜色变化缓慢的原因是_________。 ③所得无色溶液中主要阴离子为___________________。 |
(2)通过上述探究,写出新制氢氧化铜与过量SO2反应的总化学方程式______________。
反思:将表中SO2换为NO2是否能观察到相同现象?回答并解释:__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是
A. 稀醋酸与碳酸钠反应:CO![]() +2H+ == CO2↑+H2O
+2H+ == CO2↑+H2O
B. FeCl2溶液中通入Cl2:Fe2+ + Cl2 == Fe3+ + 2Cl―
C. 铜片与稀HNO3反应:Cu+2H+ == Cu2+ +H2↑
D. 用NaOH溶液吸收多余Cl2:Cl2+2OH-== Cl-+ClO-+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列电离方程式的书写,正确的是
A. NH3·H2O==NH4+ + OH― B. H2SO4==2H+ + SO42―
C. CuCl2== Cu2+ + Cl― D. NaHCO3==Na+ + H+ + CO32―
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com