
科目: 来源: 题型:
【题目】下列说法中正确的是( )
A. 离子晶体中每个离子的周围均吸引着6个带相反电荷的离子
B. 金属导电的原因是在外加电场的作用下金属产生自由电子,电子定向运动
C. 分子晶体的熔沸点低,常温下均呈液态或气态
D. 原子晶体中的各相邻原子都以共价键相结合
查看答案和解析>>
科目: 来源: 题型:
【题目】利用CO和H2可以合成甲醇,反应原理为CO(g)+2H2(g)═CH3OH(g).一定条件下,在容积为V L的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示。
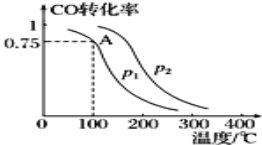
(1)p1___p2(填“>”、“<”或“=”),理由是___.
(2)该甲醇合成反应在A点的平衡常数K=___(用a和V表示).
(3)该反应达到平衡时,反应物转化率的关系是CO___H2.(填“>”、“<”或“=”)
(4)下列措施中能够同时满足增大反应速率和提高CO转化率的是___(填字母).
A. 使用高效催化剂 B.降低反应温度
C. 增大体系压强 D.不断将CH3OH从反应混合物中分离出来
查看答案和解析>>
科目: 来源: 题型:
【题目】CuCl 广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O 制备CuCl,并进行相关探究。
【资料查阅】得知:CuCl常温下是固体,露置于空气中易被氧化为绿色的高价铜盐。CuCl2·2H2O加热分解的情况如右图所示:
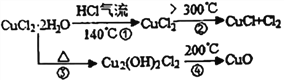
【实验探究】该小组用如图所示装置进行实验(夹持仪器已略)。
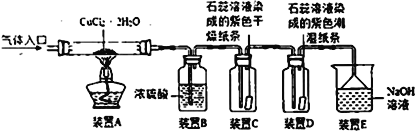
根据以上信息请回答下列问题:
(1)装置E的作用是____________________。
(2)实验操作的先后顺序是a→______________________(填操作的编号)
a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却 c.在“气体入口”处通入干燥HCl d.点燃酒精灯,加热 e.停止通入HCl,然后通入N2
(3)某同学设计的检验该装置气密性的方法是:将装置E上面的倒置漏斗换成导管,在烧杯中加少量水,将导管插入水中,在装置的气体入口处装上橡皮管,并用弹簧夹夹紧,用酒精灯微微加热玻璃管,若导管口有气泡冒出,撤去热源后,导管中有一段稳定的水柱,则装置气密性良好。你认为该同学的设计是否合理________(填“是”或“否”)。
(4)在实验过程中观察到C中纸条的颜色不变,D中纸条的先变红后褪色,其褪色的原因可能是________(填序号)。
A.氯化氢水溶液有漂白性 B.氯气的水溶液有漂白性
C.氯化氢气体有漂白性 D.干燥的氯气有漂白性
(5)停止通入HCl后,通入N2的目的是____________________。
(6)上述CuCl2·2H2O加热分解过程中④中发生反应的化学反应方程式是________________________。
(7)配平工业制备CuCl时发生反应的离子方程式:
Cu2++Cl-+SO32-+H2O→CuCl+H++SO42-,请依次写出配平后的化学计量数__________。
(8)准确称取所制备的氯化亚铜药品mg,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为__________。若滴定结束时,滴定管中有气泡,则样品中CuCl 的质量分数_________(填“偏大”或“偏小”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】从宏观现象探究微观本质是重要的化学学科素养。
I. 以亚硫酸钠(Na2SO3)为实验对象,探究其性质。实验如下:
(资料1)亚硫酸(H2SO3)易分解生成SO2和H2O。

(1)写出上述实验中①、②的离子方程式_________________,_________________。
(2)通过上述实验可知,在空气中久置的亚硫酸钠固体中会混有_____________(填化学式),亚硫酸钠在空气中变质体现了亚硫酸钠的_________________性。
II. 以FeCl3溶液为实验对象,探究其与碱性物质之间反应的复杂多样性。实验如下:

(资料2)含Fe3+的溶液中加入KSCN溶液,溶液由黄色变为红色;
含Fe2+的溶液中加入K3Fe(CN)6溶液,生成蓝色沉淀。
(1)①中反应的离子方程式是_____________________________。
(2)②中逸出的无色气体是_______________________________。
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加BaCl2溶液,产生白色沉淀。得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是_______________。
乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是_________。
(4)由上述实验可知,下列说法正确的是________(填字母)。
a. 盐与碱反应时,盐和碱都必须可溶于水
b. 盐溶液可能呈中性、碱性、酸性
c. 盐与盐反应时,不一定生成两种新盐
d. 盐与盐反应时,发生的不一定是复分解反应
查看答案和解析>>
科目: 来源: 题型:
【题目】纯碱是重要的化工原料,在医药、冶金、化工、食品等领域被广泛使用。
I. 用纯净的碳酸钠固体配制500mL 0.40mol/L Na2CO3溶液。
(1)称取Na2CO3固体的质量是______________________g。
(2)配制溶液时,进行如下操作,按照操作顺序,第4步是_________(填字母)。
a. 定容 b. 计算 c. 溶解 d. 摇匀 e. 转移 f. 洗涤 g. 称量
(3)下列说法中,正确的是_____________________(填字母)。
a. 定容时,仰视刻度线,会导致配制的溶液浓度偏小
b. 定容时,如果加水超过刻度线,要用滴管吸出
c. 转移时,溶液倒出容量瓶外,要重新配制溶液
d. 摇匀后,液面低于刻度线,要再加水至刻度线
II. 某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如下:
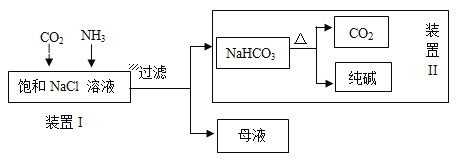
(1)工业生产纯碱的第一步是除去饱和食盐水的中SO42―、Ca2+离子,依次加入的试剂及其用量是 ______________、 _______________、 (过滤)、 _______________。
(2)已知:几种盐的溶解度
NaCl | NH4HCO3 | NaHCO3 | NH4Cl | |
溶解度(20°C,100gH2O时) | 36.0 | 21.7 | 9.6 | 37.2 |
①写出装置I中反应的化学方程式________________________________________。
②写出装置II中发生反应的化学方程式________________________________。
(3)该流程中可循环利用的物质是__________________。
(4)制出的纯碱中只含有杂质NaCl。
①检验用该纯碱配制的溶液中含有Cl―的方法是_________________________。
②测定该纯碱的纯度,下列方案中可行的是__________(填字母)。
a. 向m克纯碱样品中加入足量CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为b g
b. 向m克纯碱样品中加入足量稀盐酸,用碱石灰(主要成分是CaO和NaOH)吸收产生的气体,碱石灰增重b g
c. 向m克纯碱样品中加入足量AgNO3溶液,产生的沉淀经过滤、洗涤、干燥,称其质量为b g
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,在体积为1L的密闭容器中,A、B、C三种气体浓度的变化如图I所示,若其它条件不变,当温度分别为Tl和T2时,B的体积百分含量与时间关系如图II所示。则下列结论正确的是
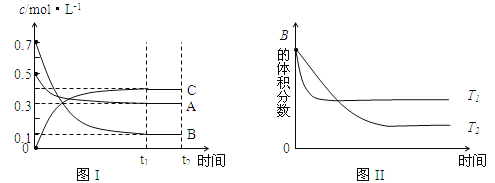
A.该反应的热化学方程式为 :A(g )+3B(g)![]() 2C(g);△H>0
2C(g);△H>0
B.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
C.达到平衡后,若其他条件不变,减小体积,平衡向逆反应方向移动
D.若其它条件不变,升高温度,正、逆反应速率均增大,A的转化率减小
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应属于取代反应的是( )
A.甲烷燃烧生成二氧化碳和水
B.乙醇与氧气反应生成乙醛
C.乙烯与溴反应生成1,2-二溴乙烷
D.甲烷与氯气反应生成一氯甲烷
查看答案和解析>>
科目: 来源: 题型:
【题目】大气污染物主要成分是SO2、NO2、NO、CO及可吸入颗粒等,主要来自于燃煤、机动车尾气和工业废气,会导致雾霾、酸雨等。
(1)大气污染物成分中属于酸性氧化物的是_______________________(填化学式)。
(2)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3。已知H2SO3是二元弱酸,写出反应的离子方程式:
①NaOH溶液吸收过量的SO2:_____________________________________________。
②氨水吸收过量的SO2:___________________________________________________。
(3)汽车的三元催化转化器中,在催化剂作用下NO和CO转化为无毒气体,反应的化学方程式是: 2CO+2NO ![]() 2CO2+N2
2CO2+N2
①该反应中,氧化剂是____________(填化学式),氧化产物是______________(填化学式)。
②当生成2mol N2时,转移电子的物质的量是___________________________。
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术,生成的产物都无毒。NH3还原NO2时,还原剂和氧化剂的物质的量之比是________________。
(5)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”。控制溶液的pH=5.5,将烟气中的SO2转化为SO42―。已知0.1mol/L 100mLNaClO溶液,可以恰好吸收0.01moL SO2,则反应的离子方程式是____。
(6)SO2通过下列过程既能制得H2SO4又能制得H2。
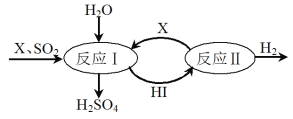
①可循环利用的物质X是_________________(填化学式)。
②制得H2SO4的化学方程式是____________________________________。
③制得H2的化学方程式是___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com