
科目: 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却 ⑨摇动
其正确的操作顺序为__________________。必须用到的玻璃仪器有烧杯、胶头滴管、________________。
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。烧杯的实际质量为________ g,要完成本实验该同学应称出________ g NaOH。

(3)使用容量瓶前必须进行的一步操作是________。
(4)如图是该同学转移溶液的示意图,图中有两处错误,请写出:

①________________________________________________________________________
②________________________________________________________________________
(5)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是________(填字母)。
A.所用NaOH已经潮解
B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里
D.用带游码的托盘天平称5.4 g NaOH(1 g以下用游码)时误用了“左码右物”方法
查看答案和解析>>
科目: 来源: 题型:
【题目】有两只密闭容器A和B,A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量SO3气体,并使A和B容积相等(如图所示)。保持400℃条件下发生反应:2SO2+O2![]() 2SO3。则下列描述正确的是( )
2SO3。则下列描述正确的是( )

A. 达到平衡所需要的时间:A容器更短
B. 达到平衡时:B容器中SO3的转化率更大
C. 达到平衡时:A容器中SO2的物质的量更多
D. 达到平衡后,向两容器中分别通入等量的氦气,A容器中SO3的体积分数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】物质的量浓度相同的三种酸HX、HY、HZ的溶液,其pH依次为4、5、6,则KX、KY、KZ的碱性由强到弱的顺序是( )
A. KX、KZ、KY B. KX、 KY、KZ
C. KZ、KY 、KX D. KY、KZ、KX
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
A. 在该条件下,反应前后的压强之比为6∶5.3
B. 若反应开始时容器体积为2 L,则v(SO3)=0.35 mol/(L·min)
C. 若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol
D. 若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Ksp(BaSO4 )= 1.1×10-10,Ksp(BaCO3)=2.5×10-9。下列说法中正确的是
A.BaCO3可以转化为BaSO4 ,反过来则不行
B.BaCO3、BaSO4均不溶于水,所以都可以做钡餐试剂
C.向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,c(SO42—)/ c(CO32—) = Ksp(BaCO3) / Ksp(BaSO4)
D.常温下,BaCO3固体若要在Na2SO4溶液中开始转化为BaSO4,则Na2SO4的浓度须大于2.2×10-6 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】(10分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 ,其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06g Na2CO3和0.84g NaHCO3,试管中各有10mL相同浓度的盐酸(如图),同时将两个侧管中的物质全部倒入各自的试管中,下列叙述正确的是
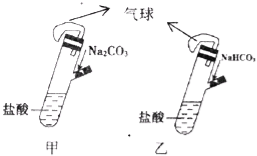
A. 甲装置的气球膨胀速率大
B. 若最终两气球体积相同,则一定有c(HCl)≥2 mol/L
C. 若最终两气球体积不同,则一定有c(HCl)≤1 mol/L
D. 最终两溶液中Na+、Cl﹣的物质的量相同
查看答案和解析>>
科目: 来源: 题型:
【题目】Ni-MH电池在工农业生产和日常生活中具有广泛用途,废旧电池中含有大量金属元素,其回收利用具有非常重要的意义。一种利用废Ni-MH电池正极材料(主要含有Ni(OH)2,还含有少量Fe、Cu、Ca、Mg、Mn、Zn的氢氧化物)制备电子级硫酸镍晶体的工艺流程如下图所示:

回答下列问题:
(1)“浸出”时温度、硫酸浓度、浸出时间对镍浸出率的影响如下图:
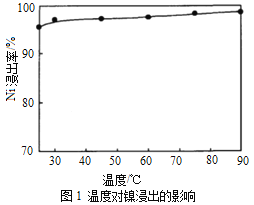
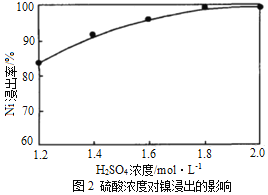
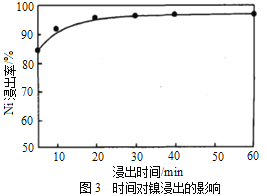
则“浸出”时最适宜的条件为_______________。
(2)在“滤液1”中加入双氧水可将Fe2+转化为难溶的针铁矿(FeOOH),写出反应的离子方程式:______________。
(3)“滤液2”中加入NaF可将滤液中Ca2+、Mg2+转化为难溶的CaF2和MgF2。当加入过量NaF后,所得“滤液3”中c(Mg2+)∶c(Ca2+)=0.67,则MgF2的溶度积为_____________[已知Ksp(CaF2)=1.10×10-10]。
(4)向“滤液3”中加入(NH4)2S2O8可以除锰,在此过程中(NH4)2S2O8与MnSO4反应生成含锰元素的一种黑色不溶物、硫酸铵及硫酸,写出该反应的化学方程式___________________。
(5)向“滤液4”加入有机萃取剂后,Zn2+与有机萃取剂(用HA表示)形成易溶于萃取剂的络合物ZnA2·2HA。该过程可以表示为:Zn2++4HA![]() ZnA2·2HA+2H+
ZnA2·2HA+2H+
①已知加入萃取剂后,锌的萃取率随料液pH变化如图所示。试分析pH增大时,锌的萃取率逐渐增大的原因是___________________。
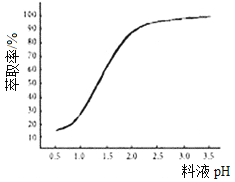
②“操作X”的名称是_____________。
(6)上述回收镍的过程中,使用了1kg含镍37.1%的正极材料,最终得到纯净的NiSO4·7H2O1.686kg,则镍的回收率为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】开放以来,人民生活水平不断提高,更加讲究合理膳食。下列饮食习惯科学的是
A. 多吃肉,少吃蔬菜水果 B. 多饮纯净水,少饮矿泉水
C. 多食用含防腐剂的食品 D. 注饮食的合理搭配
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com