
科目: 来源: 题型:
【题目】在反应2H2SO4 (浓)+Cu![]() CuSO4+2H2O+SO2 ↑中,
CuSO4+2H2O+SO2 ↑中,
(1)氧化剂是________;还原剂是________;氧化产物是________;还原产物是_______
(2)作为氧化剂的H2SO4和参加反应H2SO4物质的量之比为________;被还原的H2SO4和未被还原的H2SO4物质的量之比为________;氧化产物和还原产物物质的量之比为________;氧化剂和还原剂物质的量之比为________;
(3)在下面的化学方程式上用双线桥标电子转移的方向和数目2H2SO4 (浓)+Cu![]() CuSO4+2H2O+SO2 ↑_________
CuSO4+2H2O+SO2 ↑_________
(4)有1mol H2SO4参加反应,被氧化的Cu为______mol,转移的电子数目为________mol,生成的SO2为______L(标准状况下)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知2FeSO4![]() Fe2O3+SO2↑+SO3↑。下列有关操作、装置、原理及对现象的表述正确的是
Fe2O3+SO2↑+SO3↑。下列有关操作、装置、原理及对现象的表述正确的是

A. 用装置甲高温分解FeSO4,点燃酒精喷灯前应先向装置内通一段时间N2
B. 用装置乙可检验分解产生的SO2,现象是石蕊试液先变红后褪色
C. 用装置丙可检验分解产生的SO3,现象是产生白色沉淀
D. 用装置丁可吸收尾气,避免污染环境
查看答案和解析>>
科目: 来源: 题型:
【题目】下列措施是为了减慢化学反应速率的是
A.合成氨工业中使用催化剂
B.用铁粉代替铁钉与稀硫酸反应制取氢气
C.食品放在冰箱中贮藏
D.在试管中进行铝和盐酸反应时,稍微加热
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)3.6gH2O的物质的量是_______mol,含有_________ 个H2O,含有_____molH,含_____mol电子。
(2)标准状况下,11.2L的H2R气体质量为17g,则H2R的摩尔质量是_________,相对分子质量为________;等物质的量的NH3与H2S质量比为___________,1.7g氨气与________mol H2O含有的电子数相等。
(3)将1.06g Na2CO3溶于水配成500mL溶液,Na2CO3的浓度为______mol/L,Na+浓度为______ mol/L,将该溶液加水稀释成1000 mL后,Na+浓度为____mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】阿司匹林是一种常用的治感冒药,其结构简式如图所示,下列有关阿司匹林的说法正确的是

A. 1mol阿司匹林最多能与5mol H2反应
B. 1mol阿司匹林最多能与1molNaHCO3反应
C. 1mol阿司匹林最多能与2mol NaOH反应
D. 1mol阿司匹林与足量的Na反应生成ImolH2
查看答案和解析>>
科目: 来源: 题型:
【题目】硝基苯可与金属Fe、盐酸反应生成苯胺和FeCl2,反应如下:
![]() +3Fe+6HCl
+3Fe+6HCl![]()
![]() +3FeCl2+2H2O
+3FeCl2+2H2O
(1)写出Fe2+基态核外电子排布式:_______。
(2)苯胺分子中C、N原子的杂化方式分别是________。1mol苯胺分子中含σ键的数目是___。
(3)苯胺与盐酸反应可生成氯化苯胺盐![]() ,氯化苯胺盐中含有的化学键有______。
,氯化苯胺盐中含有的化学键有______。
(4)苯胺在水中的溶解度大于硝基苯,其原因是________。
(5)金属铁单质的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则两种晶胞中Fe原子的配位数之比为_______。
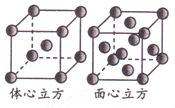
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取和储存是氢能源利用领域的研究热点。
(1)H2S 热分解制氢的原理: 2H2S(g)=2H2(g) + S2(g) △H= 169.8 kJ/mol,分解时常向反应器中通入一定比例空气,使部分H2S 燃烧,其目的是______;燃烧生成的SO2与H2S 进一步反应,硫元素转化为S2,写出反应的化学方程式:________。
(2)氨硼烷(NH3BH3) 是储氢量最高的材料之一,其受热时固体残留率随温度的变化如图甲所示。氨硼烷还可作燃料电池,其工作原理如图乙所示。

①110℃时残留固体的化学式为_________。
②氨硼烷电池工作时负极的电极反应式为_________。
(3)十氢萘(C10H18)是具有高储氢密度的氢能载体,经历“C10H18- C10H12-C10H8”的脱氢过程释放氢气。己知:
C10H18(l)![]() C10H12(l) +3H2(g) △H1
C10H12(l) +3H2(g) △H1
C10H12(l)![]() C10H8(l)+2H2(g) △H2
C10H8(l)+2H2(g) △H2
温度335℃、高压下,在恒容密闭反应器中进行液态十氢萘( 1.00 mol) 催化脱氢实验,测得C10H12和C10H8的物质的量n1 和n2随时间的变化关系如图丙所示。图丁表示催化剂对反应活化能的影响。

①△H1___△H2(选填“>”、“=”或“<”)。
② 8 h 时,反应体系内氢气的物质的量为_____mol(忽略其他副反应)。
③ n1 显著低于n2 可能的原因是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com