
科目: 来源: 题型:
【题目】利用下图装置可以进行实验并能达到实验目的的是
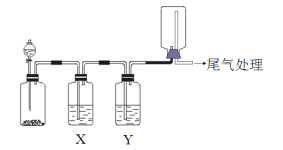
选项 | 实验目的 | X中试剂 | Y中试剂 |
A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
C | 用CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
D | 验证电石与饱和食盐水反应生成的气体的性质并收集 | CuSO4溶液 | KMnO4溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物W、X、Y、Z的分子式均为C7H8,Z的空间结构类似于篮子。下列说法正确的是
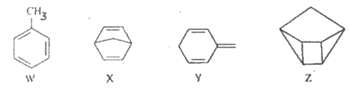
A. Z的一氯代物只有3种
B. 化合物W的同分异构体只有X、Y、Z
C. X、Y、Z均可与酸性KMnO4溶液反应
D. 1molX、1molY与足量Br2/CCl4溶液反应最多消耗Br2均为2mol
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下表数据(数据均为常温下所测数据),判断下列叙述正确的是( )

A. 在等浓度的NaClO、 NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)
B. 在等浓度的NaClO、NaHCO3混合溶液中:c(OH-)>c(HClO)>c(H2CO3)
C. 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO—=CO32—+2HClO
D. 等温等浓度的NaClO溶液和NaHCO3溶液,前者导电能力强
查看答案和解析>>
科目: 来源: 题型:
【题目】为了验证Cu和 浓H2SO4反应的产物中有SO2和H2O,选用下图所示仪器(内含物质)组装成实验装置。B中有无水硫酸铜、C中有品红、D中有氢氧化钠溶液。

(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):a接________, ______接________,________接________;
(2)若C瓶中盛有酸性高锰酸钾溶液,也观察到溶液褪色,这是因为SO2具有__________。
A.氧化性 B.还原性 C.漂白性
(3)写出A中反应的化学方程式__________.
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学欲从Fe3+、Al3+的混合液中分离并测定Fe3+的浓度,实验方案如下:

已知:①乙醚[(C2H5)2O]:沸点34.5℃,微溶于水,易燃。
②盐酸浓度较高时,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]溶于乙醚;当盐酸浓度降低时,该化合物解离。
(1)操作I的名称是_______。
(2)检验溶液Y中是否残留Fe3+的实验方法是_________ 。
(3)蒸馏装置如下图所示,该装置图中存在的错误是________。

(4)滴定前,加入的适量溶液Z是_______(填序号)。
A.H2SO4~H3PO4 B.H2SO3~H3PO4 C.HNO3~H3PO4 D.HI~H3PO4
(5)滴定达到终点时,消耗0.1000mol/LK2Cr2O7溶液5.00mL。根据该实验数据,起始所取的试样Fe3+、Al3+的混合液中c(Fe3+)为______。
(6)上述测定结果存在一定的误差,为提高该滴定结果的精密度和准确度,可采取的措施是_______。
A.稀释被测试样 B.增加平行测定次数
C.减少被测试样取量 D.降低滴定剂浓度
查看答案和解析>>
科目: 来源: 题型:
【题目】研究NO、NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)与氮氧化物有关的全球或区域性大气环境问题有_______(填字母序号)。
a.酸雨 b.沙尘暴 c.光化学烟雾 d.白色污染
(2)NO2可与水发生反应,反应的化学方程式为___________。若该反应有0.6NA个电子转移,则参加反应的NO2的物质的量为___________。
(3)NH3也是重要的含氮化合物,实验室用NH4Cl和Ca(OH)2制取NH3。
①写出反应的化学方程式_________________
②若用下图所示装置收集氨气,气体由_____口进入。

(4)硝酸可与不活泼金属铜发生反应。将过量的铜置入一定量的浓硝酸中,微热,充分反应后,待反应停止,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因是(用离子方程式解释)_____________________
(5)若将12.8 g铜跟一定质量的浓硝酸反应,铜耗完时,共产生气体5.6 L(标准状况),则整个反应过程中,被还原的HNO3总的物质的量是___________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】硝基苯可与金属Fe、盐酸反应生成苯胺和FeCl2,反应如下:
![]() +3Fe+6HCl
+3Fe+6HCl![]()
![]() +3FeCl2+2H2O
+3FeCl2+2H2O
(1)写出Fe2+基态核外电子排布式:_______。
(2)苯胺分子中C、N原子的杂化方式分别是________。1mol苯胺分子中含σ键的数目是___。
(3)苯胺与盐酸反应可生成氯化苯胺盐![]() ,氯化苯胺盐中含有的化学键有______。
,氯化苯胺盐中含有的化学键有______。
(4)苯胺在水中的溶解度大于硝基苯,其原因是________。
(5)金属铁单质的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则两种晶胞中Fe原子的配位数之比为_______。
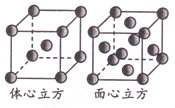
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com