
科目: 来源: 题型:
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入___溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取ag样品,并设计用如图装置来测定过氧化钠的质量分数。
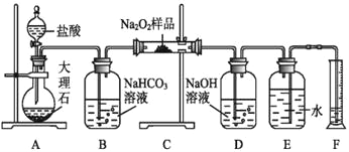
①A中发生反应离子方程式为 ____________________________________ 。
②将仪器连接好以后,必须进行的第一步操作是___________________________。
③B装置出来的气体是否需要干燥____(填“是”或“否”)。
④D中NaOH溶液的作用_______________________
⑤读出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为 _______________
⑥实验完成后E到F之间导管内残留水的体积会使测量结果________(填“偏大”“偏小”或“不影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(含BeO:25%、CuS:71%、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:

已知:I.铍、铝元素化学性质相似
II.常温下:Ksp[Cu(OH)2]=2.2×10-20、Ksp[Fe(OH)3]=4.0×10-38、Ksp[Mn(OH)2]=-2.1×10-13
(1)滤液A的主要成分除NaOH外,还有_____ (填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式_____________。
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择最合理步骤顺序______。
a.加入过量的NaOH b.通入过量的CO2 c.加入过量的氨水
d.加入适量的HC1 e.过滤 f.洗涤
②从BeCl2溶液中得到BeCl2固体的操作是________________。
(3)①MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应II中CuS 发生反应的化学方程式______________。
②若用浓HNO3溶解金属硫化物,缺点是____________(任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol/L、c(Fe3+)=0.008mol/L c(Mn2+)=0.01mol/L,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是___ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于____。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知NaH和H2O反应生成H2和NaOH,反应中1mol NaH( )
A.得到1 mol e﹣
B.失去1 mol e﹣
C.失去2 mol e﹣
D.没有电子得失
查看答案和解析>>
科目: 来源: 题型:
【题目】A~G是几种烃的分子球棍模型(如图),据此回答下列问题:


(1)常温下含碳量最高的气态烃是________(填字母)。
(2)E的一氯取代物同分异构有_______种。
(3)一卤代物种类最多的是________(填写字母)。
(4)能够与Br2发生加成反应的两种气态烃是________(填写字母)。
(5)写出C的加聚反应的化学方程式:______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,某酸H3A水溶液中含A的各种粒子的分布分数(平衡时某种粒子的浓度占各粒子浓度之和的分数)与pH关系图如下所示,下列说法正确的是
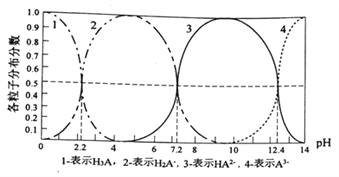
A. NaH2A水溶液呈碱性
B. H3A溶液中存在:c(H+)=c(OH-)+c(H2A-)+![]() c(HA2-)+
c(HA2-)+![]() c(A3-)
c(A3-)
C. 向H3A溶液中加入一定量的NaOH溶液至pH=5时,![]()
D. 向H3A溶液中加入氨水使PH从5→9发生的主要离子反应是:H2A-+OH-=HA2-+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,A、B、C、D、E均由上述元素组成的中学化学常见的物质,其中A是单质,C是酸性氧化物,A的水溶液和C均具有漂白性,B是自然界最常见的液体,E是三元化合物,物质之间存在如右下图所示的关系。下列说法不正确的是

A. 离子半径大小关系:Y>Z>X>W
B. YX2遇到蓝色石蕊试液先变红后褪色
C. 简单阴离子的还原性:Y>Z
D. Y与Z属于同一周期,与X属于同一主族
查看答案和解析>>
科目: 来源: 题型:
【题目】分类法是学习和研究化学的一种重要方法。下列分类不合理的是( )
A.CaO和SO3都属于氧化物
B.K2SO4和KHCO3都属于盐
C.KOH和Na2CO3都属于碱
D.H2SO4和H3PO4都属于酸
查看答案和解析>>
科目: 来源: 题型:
【题目】铈(Ce)是镧系金属元素。空气污染物NO通常用含Ce4+的溶液吸收,生成HNO2、NO3ˉ,再利用电解法将上述吸收液中的HNO2转化为无毒物质,同时生成Ce4+,其原理如图所示。下列说法正确的是
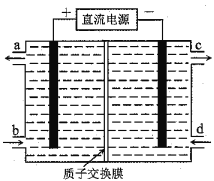
A. H+由右室进入左室
B. Ce4+从电解槽的c口流出,且可循环使用
C. 阴极的电极反应式:2HNO2+6H++6eˉ=N2↑+4H2O
D. 若用甲烷燃料电池作为电源,当消耗标准状况下33.6L甲烷时,理论上可转化HNO22mol
查看答案和解析>>
科目: 来源: 题型:
【题目】小龙同学在实验室选用碘量法测定某磁铁矿(主要成分是 Fe3O4,杂质SiO2、CuO)中铁元素质量分数,实验步骤如下:
①酸浸:取样m g,先将矿石粉碎,加入足量2mol/LH2SO4浸取,过滤后得到浸取液;
②除杂:先向浸取液中加入足量 H2S溶液,过滤后加入足量酸性 H2O2溶液氧化Fe2+(过量的H2S转化为S),再加入一定量MnO2固体除去过量的H2O2,一段时间后过滤得到Vml 滤液;
③定容:将滤液稀释至250mL,取出25.00mL于带塞子的锥形瓶中待用;
④转化:向25.00mL溶液中加入足量KI固体,塞上塞子于暗处静置30min;
⑤滴定:加入指示剂后,用cmol/LNa2S2O3标准溶液进行滴定至终点,消耗Na2S2O3标准溶液 V1mL;
⑥重复④⑤操作2次。 已知:2S2O32-+I2==S4O62-+2I-
1)①中将矿石粉碎的目的是____________________________________________,加入足量 H2SO4的目的是__________________________________。
2)写出②中加入足量 H2S 溶液发生反应的离子反应方程式:_____________________________。
3)③中用______________________________ _(填仪器名称)取出 25.00mL 溶液。
4)⑤中加入的指示剂是________,滴定终点的现象是:滴入最后一滴 Na2S2O3标准溶液 后,__________。⑥中重复进行实验的目的是______。
5)该磁铁矿中铁元素质量分数为______________(用含 m、c、V1的代数式表示,需要化简)。
6)若滴定过程中溶液 pH 过低则会导致测定结果______ (填“偏高”、“偏低”),写出 导致这种误差的离子反应方程式___________。
若②中过量的 H2O2溶液没除则会导致测定结果_____(填“偏高”、“偏低”) 若②中 MnO2固体没有过滤除去则会导致测定结果_________(填“偏高”、“偏低”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com