
科目: 来源: 题型:
【题目】向含Fe2+、I、Br的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知ba=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法正确的是
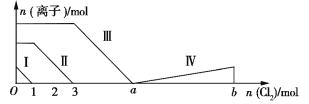
A. 线段Ⅱ表示Br的变化情况
B. 原溶液中n(FeI2)∶n(FeBr2)=3∶1
C. 根据图象无法计算a的值
D. 线段Ⅳ表示![]() 的变化情况
的变化情况
查看答案和解析>>
科目: 来源: 题型:
【题目】把碎纸片b补充到a中,可得到一个完整的离子方程式(未配平)。下列说法正确的是( )

A. 反应物微粒是S、SO![]() 、OH-
、OH-
B. 该反应可能在酸性条件下进行
C. 氧化剂与还原剂的物质的量之比为2∶1
D. 2 mol S参加反应时,转移的电子数为3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】金属铁、铜及其化合物在科学研究和工业生产中具有重要的用途。下图1表示铜与氯形成化合物A的晶胞(黑球代表铜原子)。图2是Fe3+与乙酰乙酸乙酯形成的配离子B。
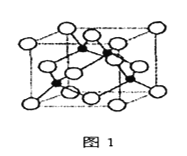
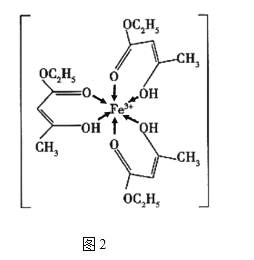
回答下列问题
(1)基态Cu原子的核外电子排布式为____________________________。
(2)从原子结构角度分析,第一电离能I1(Fe)与I1(Cu)的关系是:I1(Fe)________I1(Cu)(填“>“<”或“=”)
(3)化合物A的化学式为____________,Cl原子的配位数是____________。
(4)B中碳原子的杂化轨道类型为________,含有的化学键为________(填字母)。
a.离子键 b.金属键 c.极性键 d.非极性键
e.配位键 f.氢键 g.σ键 h.π键
(5)化合物A难溶于水,但易溶于氨水,其原因可能是________________;与NH3互为等电子体的分子有________________(写化学式,一种即可)。NH3的键角大于H2O的键角的主要原因是________________________________________。
(6)已知化合物A晶体的密度为ρg·cm-3,阿伏加德罗常数的值为NA,则该晶体中两个Cu原子之间的最短距离为________________________nm(列出计算表达式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨在工业生产中具有重要意义。
(1)在合成氨工业中I2O5常用于定量测定CO的含量。己知2I2(s)+5O2(g)=2I2O5(s) △H=-76kJ·mol-1;2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1。则该测定反应的热化学方程式为____________________________________。
(2)不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数φ (CO2)随时间t变化曲线如图。

①温度T1时,0~0.5 min内的反应速率v(CO)=________________。
②b点CO的平衡转化率α为____________,c点的平衡常数K为________________。
③下列措施能提高该反应CO转化率的是________(填字母)
a.升高温度 b.增大压强 c.加入催化剂 d.移走CO2
(3)若氨水与SO2恰好生成正盐,则此时溶液呈_________(填“酸性”或“碱性”),向上述溶液中通入___________(填“NH3”或“SO2”)可使溶液呈中性,此时溶液中含硫微粒浓度的大小关系为________________。(已知常温下NH3·H2O的Kb=1.8×10-5mol·L-1,H2SO3的Ka1=1.5×10-2mol·L-1,Ka2=6.3×10-8mol·L-1)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 27g Al与NaOH完全反应,转移的电子数为0.1NA
B. 1L 1mol/L CaC12溶液中含有的Cl-离子数目为NA
C. 标准状况下,22.4L水含有1mol水分子
D. 2mol钠与过量稀盐酸反应生成NA个氢气分子
查看答案和解析>>
科目: 来源: 题型:
【题目】关于糖类、油脂、蛋白质的叙述中,正确的是( )
A.油脂和纤维素均属于天然高分子
B.葡萄糖、蔗糖和蛋白质均能发生水解反应
C.在加热条件下葡萄糖可与新制的氢氧化铜反应
D.淀粉、油脂和蛋白质都只含C、H、O三种元素
查看答案和解析>>
科目: 来源: 题型:
【题目】海带中含碘元素,从海带中提取碘有如下步骤:( )
①通入足量Cl2②将海带焙烧成灰后加水搅拌 ③加CCl4振荡 ④用分液漏斗分液 ⑤过滤 合理的操作顺序是.
A.①②③④⑤
B.②⑤①③④
C.①③⑤②④
D.②①③⑤④
查看答案和解析>>
科目: 来源: 题型:
【题目】下图中,A是固体金属单质,燃烧时火焰呈黄色。
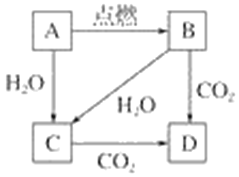
(1)写出下列符号所代表的物质的化学式:
A____________,B____________,C____________,D____________。
(2)写出下列转化的化学方程式:
①A→B________________________________________。
②B→D________________________________________。
③A→C________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com