
科目: 来源: 题型:
【题目】下列关于原电池的叙述中错误的是
A.原电池是将化学能转变为电能的装置
B.构成原电池的正极和负极必须是两种不同的金属
C.在原电池中,电子流出的一极是负极,发生氧化反应
D.原电池放电时,外电路中电流的方向是从正极到负极
查看答案和解析>>
科目: 来源: 题型:
【题目】一氯化碘是一种红棕色液体,不溶于水,溶于乙醇和乙酸,能与KI反应生成I2,用于测定油脂中的碘值等(注:碘值表示有机物中不饱和程度的指标)。某校研究性学习小组的同学拟制备一氯化碘(沸点101 ℃)。回答下列问题:
(1)甲组同学拟利用干燥纯净的氯气与碘反应制备一氯化碘,已知碘与氯气的反应为放热反应,其装置如下:
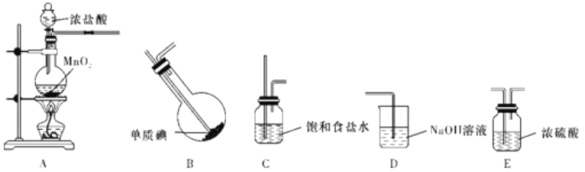
①各装置连接顺序为A→_______________________;
A中发生反应的离子方程式为________________________。
②B装置烧瓶需放在冷水中,其目的是________________________;
D装置的作用是________________________。
③B装置得到的液态产物进一步提纯可得到较纯净的ICl,采取的方法是_____。
(2)乙组同学采用最新报道制一氯化碘的方法,在三颈烧瓶中加入粗碘和盐酸,控制温度约50 ℃,在不断搅拌下逐滴加入氯酸钠溶液,生成一氯化碘,则发生反应的化学方程式为_________________________。
(3)设计实验证明:ICl的氧化性比I2强:_____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法不正确的是
A. 23gCH3CH2OH与30gCH3COOH反应,生成CH3COOCH2CH3的分子数为0.5NA
B. 15.6g由Na2S和Na2O2组成的混合物中,含有的阴离子数目为0.2NA
C. 32.5g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.5NA
D. 过量MnO2与浓盐酸反应产生1molCl2,转移的电子数目为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】氯毒素是广谱抗菌素,主要用于治疗伤寒杆菌、痢疾杆菌、脑膜炎球菌、肺炎球菌的的感染。其中一种合成路线如下:
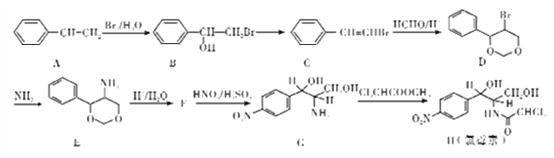
已知: 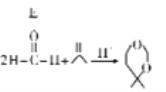
(1)A![]() B,G
B,G![]() H反应类型分别是:____、____。
H反应类型分别是:____、____。
(2)写出B![]() C的化学方程式(注明反应条件)________
C的化学方程式(注明反应条件)________
(3)写出F的结构简式_______
(4)写出H(氯霉素)分子中所们含氧官能团的名称____。1mol氯霉素最多消耗_____molNaOH。
(5)符合下列条件的E的同分异构体共有____________种。
①苯环上含有两个对位取代基,一个是氨基
②能水解
③能发生银镜反应
写出其中一种的结构简式___________
查看答案和解析>>
科目: 来源: 题型:
【题目】软锰矿主要含有MnO2(约70%)、SiO2、Al2O3,闪锌矿主要含有ZnS(约80%)、FeS、CuS、SiO2。为了高效利用这两种矿石,科研人员开发了综合利用这两种资源的同槽酸浸工艺,主要流程如下图所示,回答下列问题:
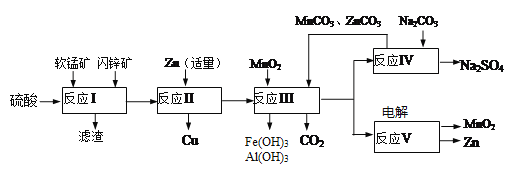
(1)反应Ⅰ所得滤液中含有Mn2+、Zn2+、Cu2+、Fe3+、Al3+等金属阴离子,所得滤液中含有S和______。为了提高硫酸“酸浸”时的浸出速率,可进行的操作是(至少两条):_________。
(2)若反成Ⅱ加入的锌过量,还会进一步发生反应的离子方程式方为_________。
(3)反应Ⅲ中加入MnO2的作用是(离子方程式表示)________;反应Ⅲ中加入MnCO3、ZnCO3的作用是________________。
(4)反应Ⅴ的电解总反应为:MnSO4+ZnSO4+2H2O![]() MnO2+Zn+2H2SO4,写出阳极的电极反应式________________。
MnO2+Zn+2H2SO4,写出阳极的电极反应式________________。
(5)MnO2和Zn可按等物质的量之比生产锌-锰干电池,则从生产MnO2和Zn的角度计算,所用软锰矿和闪铲矿的质量比大约是______。(保留小数点后两位)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)根据元素周期律,碳的非金属性强于硅,请用一个化学反应方程式表示___________________。
(2)若FeSO4和O2的系数比为2∶1,试配平下列方程式:
![]() FeSO4+
FeSO4+![]() K2O2→
K2O2→![]() K2FeO4+
K2FeO4+![]() K2O+
K2O+![]() K2SO4+
K2SO4+![]() O2↑ __________________
O2↑ __________________
(3)各种氮氧化物(NO、NO2)是主要的大气污染物之一,治理氮氧化物(NOx)废气的方法之一是用NaOH溶液进行吸收,现有NO与NO2的混合气体,将其通入50 mL 2 mol/L的NaOH溶液中,恰好完全吸收,测得溶液中含有NO3- 0.02 mol。
①所得溶液中NaNO2的物质的量为________ mol;
②混合气体中V(NO)∶V(NO2)=________。
(4)As2O3俗称砒霜,As2O3是两性偏酸性氧化物,是亚砷酸(H3AsO3)的酸酐,易溶于碱生成亚砷酸盐,写出As2O3与足量氢氧化钠溶液反应的离子方程式___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某种有机化合物的结构简式如图所示。有关该物质的说法中正确的是
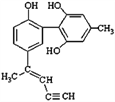
A. 该物质有四种官能团,其中一种名称为羟基
B. 1mol该物质H2反应时最多消耗H2 9mol
C. 滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
D. 该分子中的所有碳原子不可能共平面
查看答案和解析>>
科目: 来源: 题型:
【题目】下图,两电极上发生的电极反应分别为:a极:Ag++e-=Ag b极:Fe-2e-=Fe2+
下列说法正确的是( )
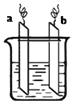
A. a极材料一定为金属银
B. b极一定连电源的正极
C. 装置中电解质溶液阳离子一定只含有Ag+
D. 装置中发生的反应方程式一定是Fe +2Ag+===Fe2++2Ag
查看答案和解析>>
科目: 来源: 题型:
【题目】FeCl2是一种常用的还原剂。实验室用无水氯化铁和氯苯来制备无水FeCl2。反应原理:2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl
2FeCl2+C6H4Cl2+HCl
熔点(℃) | 沸点(℃) | 溶解性(水) | 溶解性 (乙醇) | 溶解性 (乙醚) | 其它 | |
FeCl3、FeCl2 | 易吸水 | 易溶 | 不溶 | 不溶于C6H5Cl 、C6H4Cl2 | ||
C6H5Cl | 45 | 132 | 不溶 | 易溶 | 易溶 | |
C6H4Cl2 | 53 | 173 | 不溶 | 易溶 | 易溶 |
现设计如下方案:在A中放入16.25 g无水氯化铁和过量的氯苯,控制反应温度在128-139℃加热3 h.冷却、分离提纯得到粗产品;烧杯中所得盐酸(假设HCl完全被吸收)用AgNO3溶液滴定以测氯化铁转化率。
请回答下列问题:

(1)仪器B的名称__________
(2)仪器C中盛装的试剂可以是_______
A.无水氯化钙 B.碱石灰 C.五氧化二磷 D.浓统酸
(3)反应后通入N2的目的是___________
(4)已知20![]() :时Ksp(AgCl,白色)=1.8×10-10,Ksp(Ag2CrO4,砖红色)=3.4×10-11.
:时Ksp(AgCl,白色)=1.8×10-10,Ksp(Ag2CrO4,砖红色)=3.4×10-11.
将烧杯内溶液稀释至100 mL,每次取25.00 mL溶液进行滴定。选用K2CrO4做指示剂,用0.1000mol/L的硝酸银标准溶液滴定,三次滴定消耗标准溶液的平均体积为25.20 mL,则滴定终点的现象是______,氯化佚的转化率是______________
(5)冷却实验装置,将三颈烧瓶内物质经过过滤、洗涤、干燥后,得到粗产品,洗涤所用最佳试剂是____;回收滤液中C6H5Cl的操作方法是_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3、和FeO)得到绿矾(FeSO4·7H2O),在通过绿矾制备铁黄[FeO(OH)]的流程如下:
![]()
已知:FeS2和铁黄均难溶于水
下列说法不正确的是
A. 步骤①,最好用硫酸来溶解烧渣
B. 步骤②,涉及的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
C. 步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
D. 步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com