
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.皂化反应指的是油脂的酸性水解
B.葡萄糖和果糖互为同分异构体
C.部分蛋白质遇浓硝酸变黄色
D.驴皮熬制的阿胶中含有丰富的蛋白质
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是常温下,浓度为0.01mol/L的NaOH溶液与几种酸或盐混合后的情况:
混合组别 | 混合前酸或盐的总浓度 | 混合比例及混合溶液性质 |
① | c(HA)=0.02mol/L | 等体积混合,pH>7 |
② | HB溶液的pH=2 | V1mLNaOH溶液与V2mLHB溶液,pH=7 |
③ | c(H2C)=0.01mol/L | 等体积混合,pH>7 |
④ | c(NaHD)=0.01mol/L | 等体积混合,pH=7 |
回答下列问题:
(1)①组混合液中,HA、A-、Na+三种粒子浓度由大到小的顺序为________,若pH=8,则c(Na+)-c(A-)=________mol/L(填具体数字)。
(2)由②组混合液pH=7可推知,V1____V2。
(3)③组混合液中,pH>7的原因是______________________。
(4)0.01mol/LNaHD溶液中,水的电离度=_________。(已知:水的电离度=[已电离的水分子的个数/水分子总数]×100%)
(5)仅凭上述结果,一定能确定HA、HB、H2C、H2D四种酸中属于弱酸的是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用图1所示装置制备KClO溶液,并通过KClO溶液与FeCl3溶液的反应制备高效水处理剂K2FeO4。
已知K2FeO4具有下列性质: ①可溶于水,微溶于饱和KOH溶液;②在0~5℃的强碱性溶液中比较稳定;③在Fe3+和Fe(OH)3催化作用下发生分解;④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。
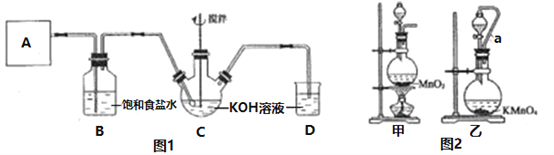
回答下列问题:
(1)装置A用于产生氯气,若选用图2中的甲装置,反应的离子方程式是________,若选用装置乙,其中的导管a的作用是________。
(2)Cl2与KOH在较高温度下反应生成KClO3。在不改变KOH溶液的浓度和体积的条件下,控制反应在0~5℃进行。实验中可采取的措施是________;在通入氯气的过程中,不断搅拌的目的是_____________。
(3)制备K2FeO4时,KClO饱和溶液与FeCl3饱和溶液的混合方式为______,反应的离子方程式是____________。
(4)提纯K2FeO4粗产品[含有Fe(OH)3、KCl等杂质]的实验方案为:将K2FeO4粗产品溶于冷的3mol/LKOH溶液中________(填操作名称),将滤液置于冰水浴中,再加入______,搅拌、静置、再过滤,晶体用适量乙醇洗涤2~3次后,在真空干燥箱中干燥。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是重要的化学试剂、化工原料和有广阔发展前景的新能源。以甲醇为原料制备氢气的一种原理如下:
i.CH3OH(g) ![]() CO(g)+2H2 △H =+90kJ·mol-1
CO(g)+2H2 △H =+90kJ·mol-1
ii.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H =-41kJ·mol-1
CO2(g)+H2(g) △H =-41kJ·mol-1
(1)向VL恒容密闭容器中充入lmolCH3OH(g),发生反应i。图I中能正确表示CHOH(g)的平衡转化率(a)随温度(T)变化关系的曲线为_______________(填“A”或“B”),理由为_____________。T1℃时,体系的平衡压强与起始压强之比为_________________________。

(2)起始向10L恒容密闭容器中充入lmolCH3OH(g)和1molH2O(g),发生反应i利反应ii,体系中CO的平衡体积分数与温度(T)和压强(p)的关系如图2所示。
①随着温度升高,n(CO2)/n(CO)的值______(填“增大““减小”或“不变”),理由为____________。
②p1、p2、p3由大到小的顺序为___________________。
③测得C点时、休系中CO2的物质的量为0.2mol,则T2℃时,反应ii的平衡常数K=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向20mL0.5mol/L的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如下图所示:
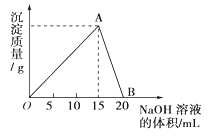
(1)写出AB段发生反应的离子方程式___________。
(2)A点表示的意义是__________。
(3)当所得沉淀量为0.39g时,用去NaOH溶液的体积是_______mL或______mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】烃类有机物在生活和生产中发挥着重要作用,研究它们意义重大。请回答下列问题:
(1)写出乙烷制氯乙烷的方程式______________________________,其反应类型为____________。
(2)写出以乙醇为原料经过两步反应制备乙烯的方程式,并指出第二步反应的反应类型。
第一步:__________________________________;
第二步:______________________,其反应类型为___________________。
(3)0.2mol某烃A在氧气中宋个燃烧后,生成CO2利H2O各1.2mol。若烃A不能使溴水褪色,但在一定条化下能与氯气发生取代反应,其一氯取代物有两种,则烃A的结构简式为___________________。
(4)在一定条件下,某些不饱和烃分子可以进行自身加成反应。例如:
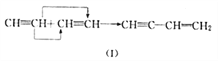
①参照(I)则有机物A![]() ,可由____________(填结构简式)相互加成制取。
,可由____________(填结构简式)相互加成制取。
②参照(I)当两分子丙烯发生自身加成时生成主链为4个碳原子的烃B,则B的结构简式为______,用系统命名法命名B_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。
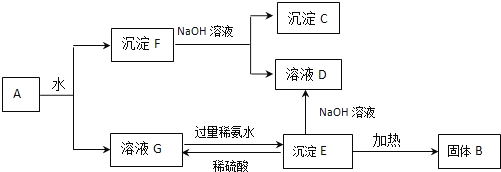
请回答下列问题。
(1)固体B____________、沉淀C____________(填化学式)。
(2)沉淀F与NaOH溶液反应的离子方程式为________________________________。
沉淀E与稀硫酸反应的离子方程式为____________________________________。
溶液G与过量稀氨水反应的离子方程式为________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气的制取与储存是氢能源利用领域的研究热点。回答下列问题:
(1)直接热分解法制氢
某温度下,2H2O(g)![]() 2H2(g)+O2(g),该反应的平衡常数表达式为K=______。
2H2(g)+O2(g),该反应的平衡常数表达式为K=______。
(2)乙醇水蒸气重整制氢
反应过程和反应的平衡常数(K)随温度(T)的变化曲线如图1所示。某温度下,图1所示反应每生成1molH2(g),热量变化是62kJ,则该反应的热化学方程式为_____________。
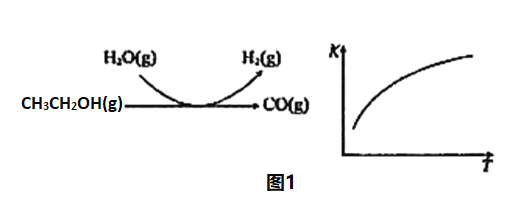
(3)水煤气法制氢
CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
在进气比[n(CO):n(H2O)]不同时,测得相应的CO的平衡转化率见图2(图中各点对应的反应温度可能相同,也可能不同)。
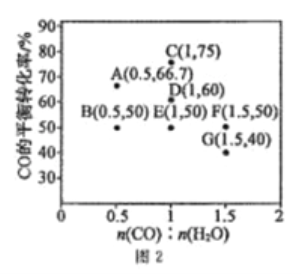
①向2L恒温恒容密闭容器中加入一定量的CO和0.1molH2O(g),在图中G点对应温度下,反应经5min达到平衡,则平均反应速率v(CO)=________。
②图中B、E两点对应的反应温度分别为TB和TE,则TB_____TE(填“>”“<”或“=”)。
③经分析,A、E、G三点对应的反应温度都相同(均为T℃),其原因是A、E、G三点对应的_________相同。
④当T℃时,若向一容积可变的密闭容器中同时充入3.0molCO、1.0molH2O(g)、1.0molCO2和x molH2,为使上述反应开始时向正反应方向进行,则x应满足的条件是______。
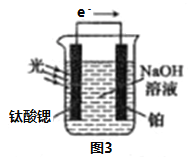
(4)光电化学分解制氢
反应原理如图3,钛酸锶光电极的电极反应式为4OH--4e-=O2↑+2H2O,则铂电极的电极反应式为________________。
(5)Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数约为7.7%)。该反应的化学方程式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】砷化镓是继硅之后研究最深入、应用最广泛的半导体材料。回答下列问题:
(1)Ga基态原子核外电子排布式为__________________,As基态原子核外有____个未成对电子。
(2)Ga、As、Se的第一电离能由大到小的顺序是___________,Ga、As、Se的电负性由大到小的顺序是_________________。
(3)比较下列镓的卤化物的熔点和佛点,分析其变化规律及原因:_________________。
镓的卤化物 | GaI3 | GaBr3 | GaCl3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是______________。
(4)二水合草酸镓的结构如图1所示,其中镓原子的配位数为___________,草酸根中碳原子的杂化轨道类型为______________。

(5)砷化镓的立方晶胞结构如图2所示,晶胞参数为a=0.565nm,砷化镓晶体的密度为_____g/cm3(设NA为阿伏加德罗常数的值,列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com