
科目: 来源: 题型:
【题目】向Fe 2 (SO 4 ) 3 和Al 2 (SO 4 ) 3 的混合溶液中,逐滴加入NaOH溶液至过量。下列图象中,能正确表示上述反应的是
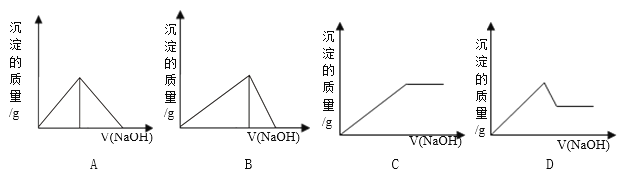
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,0.2 mol·L-1的一元酸HA与等浓度NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )

A. HA为强酸
B. 该混合溶液pH=7.0
C. 该混合溶液中:c(A-)+c(Y)=c(Na+)
D. 图中X表示HA,Y表示OH-,Z表示H+
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A. 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B. 0.1mol/LNa2CO3溶液与0.1mol/LNaHCO3溶液等体积混合:2c(Na+)=3c(CO32-)十3c(HCO3-)+3c(H2CO3)
C. 0.1mol/LNH4Cl溶液与0.1mol/L氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
D. 0.1mol/LNa2C2O4溶液与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某反应aX(g)+bY(g)=cZ(g)的各物质浓度数据如下:
X | Y | Z | |
起始浓度(molL-1) | 0.3 | 0.5 | 0 |
5s末浓度(molL-1) | 0.1 | 0.4 | 0.3 |
据此可推算出上述化学方程式中X、Y、Z三种物质的化学计量数之比是( )
A.2:1:3
B.3:1:2
C.1:4:3
D.3:2:1
查看答案和解析>>
科目: 来源: 题型:
【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)可用于全固态钙钛矿敏化太阳能电池的敏化剂,由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
共价键 | C-O | H-O | N-H | C-N |
键能/kJmol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=________kJmol-1
(2)上述反应中所需甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g)![]() CH3OH(g)△H<0。在一定条件下,将lmolCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g)△H<0。在一定条件下,将lmolCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
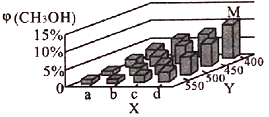
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为____________________。
②X轴上a点的数值比b点_______(填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是______________________________________。
(3)常温下,已知:Ksp(PbI2)=4×10-9;已知Ksp(PbCl2)=1.6×10-5,则反应PbCl2(s)+2I-(aq)![]() PbI2(s)+2Cl-(aq)的平衡常数K=_______________。
PbI2(s)+2Cl-(aq)的平衡常数K=_______________。
(4)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:
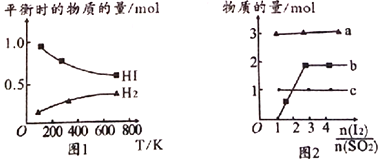
①反应H2(g)+I2(g)![]() 2HI(g)的△H_______(填“>”或“<”)0。
2HI(g)的△H_______(填“>”或“<”)0。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O![]() 3H++HSO4-+2I-,I2+I-
3H++HSO4-+2I-,I2+I-![]() I3-,图2中曲线a、b分别代表的微粒是_______、__________(填微粒符号);由图2知要提高碘的还原率,除控温度外,还可以采取的措施是减小___________________________________。
I3-,图2中曲线a、b分别代表的微粒是_______、__________(填微粒符号);由图2知要提高碘的还原率,除控温度外,还可以采取的措施是减小___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-11。某溶液中含有Cl-,Br-,CrO42-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A. Cl-、Br-、CrO42- B. CrO42-、Br-、Cl-、
C. Br-、Cl-、CrO42- D. Br-、CrO42-、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于原电池的叙述中,正确的是( )
A.原电池的负极上发生还原反应
B.原电池工作时,电子总是由负极经导线流入正极
C.原电池中,正、负极的电极材料一定都是金属单质
D.酸碱中和反应也可以设计成原电池
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式错误的是
A. 盐酸与烧碱溶液反应:H++OH-===H2O
B. 澄清石灰水中通入CO2变浑浊:CO2+Ca2++2OH-===CaCO3↓+H2O
C. 向氯化铝溶液中加入足量氨水:Al3++3OH-===Al(OH)3↓
D. Cl2与水反应生成盐酸和次氯酸:Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
查看答案和解析>>
科目: 来源: 题型:
【题目】四川师范大学化学与材料学院对“铁与水蒸气反应”实验研究的结果显示:在80~100℃能产生稳定水蒸气的物质都可以作为该反应的供水剂;铁与水蒸气反应温度在500℃左右即可顺利进行。
某化学兴趣小组同学利用该研究结论,采用西红柿(或洋葱)作为供水剂,设计了如图装置进行实验,并对铁与水蒸气反应的产物进行检验。

回答下列问题:
(1)A中铁与水蒸气反应的化学方程式是_______________。
(2)C中碱石灰的作用是______________。
(3)D处实验现象为___________________________。
(4)上述实验结束后,取出A中铁粉反应后的少量固体继续进行如下实验:

①加入稀硫酸发生的离子方程式为______________________________。
②试剂A是_____________(选填字母),现象2为___________________。
a .NaOH溶液 b. 酸性KMnO4溶液 c .酚酞 d . 氯水
③若用电子天平称取铁粉质量为0.1527g,测得生成氢气体积为73.50mL(实验室条件下气体摩尔体积为24.5L/mol).则参加反应的铁粉占称取铁粉的百分数为_____(精确到0.1%)。
④有同学认为:即使得到了现象1和现象2的实验现象,也不能确定所得固体成分为Fe3O4。你认为该同学持此看法的理由是_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,现有0.1mol·L-1NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是

A. 当pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3·H2O)>c(CO32-)
B. NH4HCO3溶液中存在下列关系:![]() <1
<1
C. 向pH=6.5的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3-浓度逐渐减小
D. 分析可知,常温下水解平衡常数Kh(HCO3-)的数量级为10-7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com