
科目: 来源: 题型:
【题目】化学探究小组设计实验探究某种氮的化合物的制备及性质。
【探究一】下图A为某气体制备装置,图中未画出。
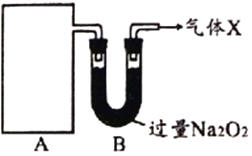
据此回答:
(1)①只用一种试剂制备A中某气体,选取的试剂是____________。
a.NH4HCO3 b.NH4Cl c.Ca(OH)2 d.NH4NO3
②装置A所用的主要玻璃仪器是____________(填仪器名称)。
(2)从装置A进入装置B的物质在B中被充分吸收,写出B中发生反应的化学方程式_______________________________(写出一个即可)。
【探究二】为探究上述装置中产生的气体性质,该化学探究小组又组装了如下装置,其中C处硬质试管中装有红色粉末铜粉。
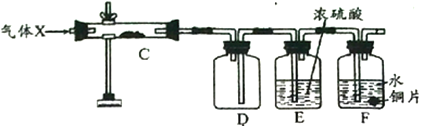
用酒精灯加热C处硬质试管一段时间后,再通入上述实验产生的气体,过一会撤去C处酒精灯。
据此回答:
(3)若实验过程中发现F处铜片逐渐溶解。则:
①D中观察到的现象是________________________________。
②C中发生反应的化学方程式为________________________________。
③F处铜片逐渐溶解的原因是________________________________。
④该装置的不足之处是________________________________。
(4)若实验过程中F处铜片没有任何变化,D中无任何现象发生,只观察到C中粉末在红色和黑色间交替变化。则C中发生反应的化学方程式为________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某蓄电池的反为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
(1)该蓄电池充电时,发生还原反应的物质是_______(填选项字母)。放电时生成Fe(OH)2的质量为18g,则外电路中转移的电子数是_________________。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常在船体上镶嵌Zn块,或与该蓄电池的____(填“正”或“负”)极相连。
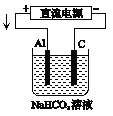
(3)以该蓄电池作电源,用如图所示的装置在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用两为个相关的方程式表示)①_________________②__________________________。
(4)精炼铜时,粗铜应与直流电源的______(填“正”或“负”)极相连。精炼过程中,电解质溶液中的c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。甲同学设计如下除杂方案:
![]()
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀时的pH | 2.3 | 7.5 | 5.6 | 6.2 |
完全沉淀时的pH | 3.9 | 9.7 | 6.4 | 8.0 |
则加入H2O2的目的是____________________________________。乙同学认为应将方案中的pH调节到8,你认为此观点________(填“正确”或“不正确”),理由是___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高分子化合物M(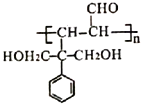 )和高分子化合物J用途广泛。其合成路线如下图所示:
)和高分子化合物J用途广泛。其合成路线如下图所示:
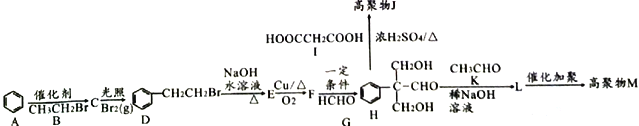
已知:①![]()
②CH3CHO+HCHO![]() HOH2C-CH2-CHO
HOH2C-CH2-CHO
③CH3CHO+HCHO![]() CH2=CH-CHO+H2O
CH2=CH-CHO+H2O
回答下列问题:
(1)有机物C的名称是___________________。
(2)D到E和E到F的反应类型分别是__________________、______________________。
(3)有机物L的结构简式为______________________。
(4)控制反应条件保证H中醛基不被氧化,H与I发生缩聚反应得到高聚物J的化学方程式为___________________________________________。
(5)有机物F的催化氧化产物满足下列条件的同分异构体有_______种;其中核磁共振氢谱有4组峰的结构简式为____________________;
①含有苯环 ②能够发生银镜反应 ③与FeCl3溶液不发生显色反应
(6)根据本题的条件设计用![]() 、CH3Cl、CH3CH2CHO合成
、CH3Cl、CH3CH2CHO合成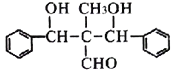 的路线。___________________
的路线。___________________
查看答案和解析>>
科目: 来源: 题型:
【题目】O2、O3、N2、N4是氧和氮元素的几种单质。回答下列问题:
(1)O原子中价电子占据的轨道数目为__________________。
(2)第一电离能I1:N____O(填“>”或“<”),第二电离能I2:O大于N的原因是__________________。
(3)O3的空间构型为_________________;是_____________(填“极性”或“非极性”)分子;分子中存在的大π键,可用符号![]() 表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为_______________________。
表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为_______________________。
(4)N元素的简单气态氢化物NH3在H2O中溶解度很大,其原因之一是NH3和H2O可以形成分子间氢键,则在氨水中氢键可以表示为H3N…H-N、___________、____________ (任写两种即可)。
(5)已知:如下键能和键长数目。
化学键 | 键长/pm | 键能/ |
N-N | 145 | 193 |
N=N | 125 | 418 |
N | 110 | 946 |
N2和N4都是N元素的单质,其中N4是正面体构型,N原子占据四面体的四个顶点,从键参数角度分析N4分子稳定性远小于N2原因是________________________________________。
(6)Na2O的晶胞结构如下图所示,X表示O2-,Y表示Na+,则O2-的配位数为_______________,该晶胞的原子空间利用率为_______________;(已知该晶胞的棱长为apm,r(Na+)=xpm,r(O2-)=ypm)。
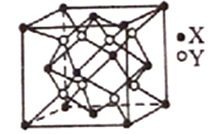
查看答案和解析>>
科目: 来源: 题型:
【题目】液流电池是一种新的蓄电池,是利用正负极电解液分开,各自循环的一种高性能蓄电池,具有容量高、使用领域(环境)广、循环使用寿命长的特点。如图是一种锌溴液流电池,电解液为溴化锌的水溶液。下列说法正确的是

A.充电时阳极的电极反应式:Zn-2e- ![]() Zn2+
Zn2+
B.充电时电极a为外接电源的负极
C.放电时Br-向右侧电极移动
D.放电时左右两侧电解质储罐中的离子总浓度均增大
查看答案和解析>>
科目: 来源: 题型:
【题目】某铬铁矿主要成分是FeO·Cr2O3,含有FeCO3、SiO2、Fe3O4等杂质,现由该铬铁矿制备强氧化剂Na2Cr2O7的流程如下:
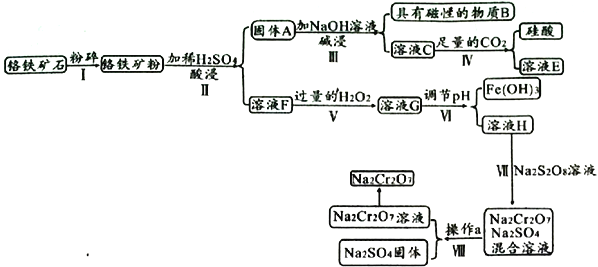
已知:常温下,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Cr(OH)3]=6.3×10-30
回答下列问题:
(1)物质B为______________,溶液E为____________________。
(2)溶液G中经检测不含H2O2的可能原因是________________________________________。
(3)若步骤Ⅵ调节pH后,c(Cr3+)=6.3mol/L,则pH范围是______________(离子浓度不大于1.0×10-5mol/L即可认为沉淀完全)。
(4)步骤Ⅶ发生的离子方程式为________________________________________。
(5)Na2Cr2O7和Na2SO4的溶解度随温度变化的曲线如下图所示,步骤Ⅷ中操作a为___________、__________________。
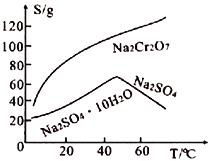
(6)若称取mg该铬铁矿,其中FeO·Cr2O3的质量分数为70%,最终制得ng Na2Cr2O7固体,则该过程中Cr元素的转化率为____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )
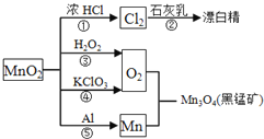
A. 反应①②③④⑤均属于氧化反应和离子反应
B. 反应⑤说明该条件下铝的还原性强于锰
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1︰1
D. 反应①中氧化剂与还原剂的物质的量之比为1︰4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com