
科目: 来源: 题型:
【题目】已知A为常见的金属单质,根据如图所示的转化关系回答下列问题。
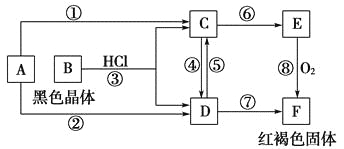
(1)确定A、B、C、D、E、F的化学式:
A为________,B为________,C为________。
D为________,E为________,F为________。
(2)写出⑧的化学方程式及④、⑤的离子方程式:___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是在实验室进行二氧化硫制备与性质实验的组合装置,回到下列问题:
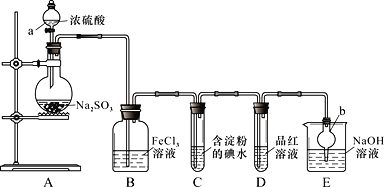
(1)仪器名称:a_____,b_____。装置A中制取SO2时不能用稀H2SO4代替浓H2SO4,原因是________________________。
(2)为了验证B中发生了氧化还原反应,应向B中加入下列试剂中的______(填序号)。
①KMnO4溶液 ②稀盐酸酸化的BaCl2溶液 ③NaOH溶液 ④KSCN溶液
能说明I-还原性弱于SO2的现象为________;发生反应的离子方程式是_______。
(3)要验证SO2与品红反应的产物不稳定,实验操作方法及现象是_______________。实验中的尾气用NaOH溶液吸收,反应的离子方程式是_______________。
(4)铜与浓硫酸在加热条件下反应也可制SO2,该反应体现了浓H2SO4的哪些性质?________,反应的化学方程式是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铋(Bi)与氮同族,氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂、油漆调色、生产金属铋等。一种以用火法炼铜过程产生的铜转炉烟尘(除含铋的化合物之外,还有CuSO4、ZnSO4、CuS、Fe2O3、PbSO4及As2O3)制备高纯氯氧化铋的工艺流程如下:

请回答:
(1)BiOCl中Bi元素的化合价为__________。
(2)向“酸浸”所得“浸液1”中加入Zn粉,主要目的是__________________________。
(3)“浸铜”时,有单质硫生成,其反应的离子方程式为____________________________。
(4)“浸铋”时,温度升高,铋的浸出率降低,其原因为____________________________。
(5)“沉铋”时需控制溶液的pH=3.0,此时BiCl3发生反应的化学方程式为__________。
(6)“除铅、砷”时,可以采用以下两种方法:
①加入改性羟基磷灰石固体(HAP):浸液2与HAP的液固比(L/S)与铅、砷去除率以及后续沉铋量的关系如下表:
L/S | 125∶1 | 50∶1 | 25∶1 | 15∶1 |
Pb2+去除率/% | 84.86 | 94.15 | 95.40 | 96.83 |
As3+去除率/% | 98.79 | 98.92 | 98.34 | 99.05 |
m(沉铋)/g | 2.34 | 2.33 | 2.05 | 1.98 |
实验中应采用的L/S=__________。
②铁盐氧化法:向浸液2中加入Fe2(SO4)3,并调节pH,生成FeAsO4沉淀。当溶液中c(AsO43-)=1×10-9mol/L,且不产生Fe(OH)3沉淀,此时溶液的pH为__________。(已知:1g2=0.3;FeAsO4、Fe(OH)3的Ksp分别为5×10-21、4×10-38。)
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室有质量分数为98%的浓硫酸,密度为1.84 g·cm-3。现要配制0.5mol/L的稀硫酸450 mL,试回答下列问题:
(1)该浓硫酸的物质的量浓度为_________。配制稀硫酸时,应选用规格为______mL的容量瓶,经计算需要__________mL浓硫酸。
(2)在量取浓硫酸后,进行了下列操作,其正确顺序是________________(填序号)。
a. 待稀释硫酸的温度与室温一致后,沿玻璃棒注入容量瓶中。
b. 往容量瓶中小心加蒸馏水至液面离刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的凹液面与刻度标线相切。
c. 用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部注入容量瓶。
d. 将浓硫酸慢慢注入盛蒸馏水的烧杯中,边倒边用玻璃棒搅动,使其混合均匀。
e. 将容量瓶盖紧,反复上下颠倒,摇匀。
(3)下列操作会导致所配硫酸浓度偏低的是______。
A.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
B.用量筒量取浓硫酸时,俯视读数
C.定容时仰视容量瓶刻度线
D.定容摇匀后有少量溶液外流
E. 定容摇匀后,发现液面下降,继续加水至刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】2:326.26.26 联合国将2011年定为“国际化学年”,主题是“化学,人类的生活,人类的未来”,以鼓励青年人热爱化学。学习化学应该明白“从生活中来,到生活中去”的道理。

请填空:
(1)成人每天应从食物中摄取的几种元素的质量分别为: Mg 300 mg、Ca 800 mg、Fe 14 mg、Cu 1.6 mg,这些元素的物质的量之比为_________。
(2)病人输液用的葡萄糖注射液是葡萄糖(化学式C6H12O6)的水溶液,其标签上的部分内容如右图所示。利用标签所提供的信息,计算出该注射液中葡萄糖的物质的量浓度为__________。
(3)SO2有毒,但葡萄酒里都含有微量SO2,起保鲜、杀菌和抗氧化作用,抗氧化作用利用了SO2的_______性。“硅胶”常用作实验室和袋装食品、瓶装药品等的干燥剂,也可以用作_______的载体。实验室可用________溶液来鉴别某未知液是苏打水还是水玻璃。
查看答案和解析>>
科目: 来源: 题型:
【题目】“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ/mol
C(s)+O2(g)=CO2(g)△H2=-393.5kJ/mol
2C(s)+O2(g)=2CO(g)△H3=-221kJ/mol
若某反应的平衡常数表达式为:K=[c(N2) ·c2(CO2)]/[c2(NO) ·c2(CO)],则此反应的热化学方程式为____________________________________。
(2)N2O5在一定条件下可发生分解:2N2O5(g)![]() 4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
t/min | 0 | 1 | 2 | 3 | 4 | 5 |
c(N2O5)/<mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为p0,第2min时体系压强为p1,则p1∶p0=__________。2~5min内用NO2表示的该反应的平均反应速率为__________。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是__________。(填字母)。
a.NO2和O2的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5) d.气体的密度保持不变
(3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g)![]() NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为__________(用k正、k逆表示)。
NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为__________(用k正、k逆表示)。
(4)如图是密闭反应器中按n(N2) ∶n(H2)=1∶3投料后,在200℃、400℃、600℃下,合成NH3反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线,已知该反应为放热反应。
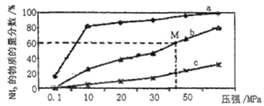
①曲线a对应的温度是__________。
②M点对应的H2的转化率是__________。
(5)工业上常用氨水吸收二氧化硫,可生成(NH4)2SO3。判断常温下(NH4)2SO3溶液的酸碱性并说明判断依据:______________________________________________。(已知:NH3·H2O的Kb=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8。)
查看答案和解析>>
科目: 来源: 题型:
【题目】现有三组:①CCl4和氯化钠溶液;②硝酸钾溶液中少量氯化钠;③氯化钠溶液和碘的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、过滤、蒸馏
B.过滤、结晶、分液
C.蒸馏、分液、萃取
D.分液、结晶、萃取
查看答案和解析>>
科目: 来源: 题型:
【题目】钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位。用含有Fe2O3的钛铁矿(主要成分为FeTiO3)制取TiO2的流程如下:
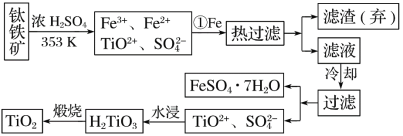
(1)步骤①加Fe的目的是________________________________________________________;步骤②冷却的目的是________________________________________________________。
(2)上述制备TiO2的过程中,可以利用的副产物是______________________。
(3)由金红石(TiO2)制取单质Ti,涉及到的步骤为TiO2―→TiCl4![]() Ti,反应TiCl4+2Mg===2MgCl2+Ti在Ar气氛中进行的理由是_________________________。
Ti,反应TiCl4+2Mg===2MgCl2+Ti在Ar气氛中进行的理由是_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于物质的量浓度表述错误的是
A. 将6.2 g氧化钠溶于水配成1L溶液,其中溶质的物质的量浓度为0.2mol·L-1
B. 将1 L0.2 mol·L-1 Ca(NO3)2溶液稀释到10 L时,NO![]() 的浓度为0.04 mol·L-1
的浓度为0.04 mol·L-1
C. 用1L水吸收标准状况下的22.4L氨气所得氨水中,c(NH3·H2O)=1mol·L-1
D. 5 mL2 mol·L-1 NaCl溶液和10 mL 0.5 mol·L-1 MgCl2溶液中,n(Cl-)相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com