
科目: 来源: 题型:
【题目】向体积均为10mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1 mol·L-1盐酸,此时反应生成CO2体积(标准状况)与所加盐酸体积间的关系如图所示。则下列叙述中正确的是

A. 原NaOH溶液的物质的量浓度为0.5 mol·L-1
B. 当0<V(HCl)<10mL时,甲溶液中发生反应的离子方程式为OH-+H+=H2O
C. 乙溶液中含有的溶质是Na2CO3、NaHCO3
D. 乙溶液中滴加盐酸后产生CO2体积的最大值为224mL(标准状况)
查看答案和解析>>
科目: 来源: 题型:
【题目】氨是重要的无机化工产品之一,在国民经济中占有重要地位。我国采用铁触媒(以铁为主的混合物)做催化剂合成氨。回答下列问题:
(1)Fe基态原子核外电子排布式为____。氮化铁是一种重要的无机化合物,不溶于水,暴露在潮湿环境中可释放出氨气,元素Fe和N中,第一电离能较大的是_____,基态原子核外未成对电子数较多的是_______。
(2)N的氧化物有N2O等,N2O与CO2互为等电子体,N2O的空间构型为__________。
(3)N有多种氢化物,其中肼(N2H4)常用作火箭推进剂的燃料,N2H4中N原子的杂化形式为____。
(4)N、P、As为同族元素,NH3、PH3、AsH3三种物质的沸点由高到低的顺序为_____。原因是____。
(5)K3[Fe(CN)6]常用于检验Fe2+,K3[Fe(CN)6]中存在的化学键类型有_______。
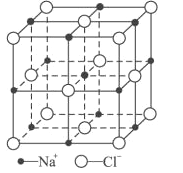
(6)FeO晶体的晶胞与NaCl的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为428pm,则该晶体的密度为____g/cm3(列出计算式即可,用NA表示阿伏加德罗常数的值)。
 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理,对于消除环境污染有重要意义。回答下列问题:
(1)已知2NO(g) +O2(g)![]() -2NO2(g) △H的反应历程分两步:
-2NO2(g) △H的反应历程分两步:
①2NO( g )![]() N2O2 (g)( 快 ) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
N2O2 (g)( 快 ) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
②N2O2 (g)+ O2 (g) ![]() 2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)c(O2),v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)c(O2),v2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小: E1__ E2 (填“>”、“<”或“=”) 其判断理由是__________;2NO(g) +O2(g)![]() 2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g)
2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g) ![]() 2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
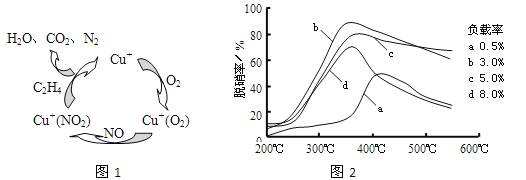
(2)①以乙烯(C2H4)作为还原剂脱硝(NO),其脱硝机理如左下图所示,若反应中n(NO): n(O2) =2 :1,则总反应的化学方程式为_______________;脱硝率与温度、负载率(分子筛中催化剂的质量分数) 的关系如右下图,为达到最佳脱硝效果,应采用的条件是________________。
②用NO可直接催化NO分解生成N2、O2,将其反应机理补充完整(Vo代表氧空穴):
2Ni2++2Vo+2NO→2Ni3++2O-+N2 2O-→O2-+1/2O2+Vo ______________
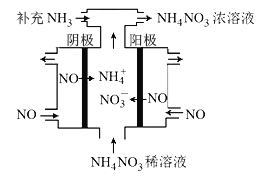
(3)电解NO可制备NH4NO3,其工作原理如图所示,阴极的电极反应式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.100mol/L 的AgNO3溶液滴定50.0mL,0.0500mol/L KCl溶液,以K2CrO4为指示剂,测得溶液中pCl=-lgc(Cl-) 、pAg=-lgc(Ag+)随加入AgNO3的体积变化如图所示,已知溶液中离子浓度小于等于1.0×10-5mol/L则沉淀完全,Ksp(Ag2CrO4)=2.0×10-12,Ksp(Ag2SO4)=1.4×10-5,下列说法错误的是( )
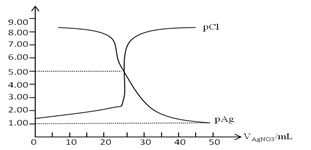
A. AgCl的沉淀溶解平衡常数Ksp数量级为10-10
B. 为防止指示剂失效,溶液应维持中性或弱碱性
C. 滴定中指示剂的有效浓度应维持在2.0×10-2 mol/L
D. 滴定完后加入1mL 0.01mol/L H2SO4会产生新的沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①2HI+Cl2=2HCl+I2,②2Fe+3Cl2=2FeCl3,③2FeBr2+3Cl2=2FeCl3+2Br2.在一定条件下HI、Fe、FeBr2分别与足量的Cl2反应,如果三个反应电子转移数目相等,则HI、Fe、FeBr2的物质的量之比为
A. 1:1:1 B. 1:3:3 C. 3:1:1 D. 6:3:2
查看答案和解析>>
科目: 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)![]() CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是

A. 该反应的△H<0,且p1<p2
B. 反应速率:ν逆(状态A)>ν逆(状态B)
C. 在C点时,CO转化率为75%
D. 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol/LCuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是

已知:lg2=0.3,Ksp(ZnS)=3×10-25 mol2/L2。
A. a、b、c三点中,水的电离程度最大的为b点
B. Na2S溶液中:c(H+)+c(HS-)+c(H2S)= c(OH-)
C. 该温度下Ksp(CuS)=4×10-36 mol2/L2
D. 向100 mL Zn2+、Cu2+浓度均为10-5 molL-1的混合溶液中逐滴加入10-4 molL-1的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com