
科目: 来源: 题型:
【题目】石墨和金刚石都是碳元素的单质,已知C(石墨,s)=C(金刚石,s) △H>0,下列说法正确的是
A. 石墨不如金刚石稳定
B. 等质量的石墨与金刚石完全燃烧,二者放出的热量相等
C. 等质量的石墨与金刚石完全燃烧,金刚石放出的能量少
D. 金刚石不如石墨稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W有如图所示的转化关系(反应条件和部分其它反应物省略),则X、Y、Z可能是( )
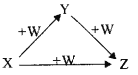
①Na、Na2O、Na2O2 ②AlCl3、Al(OH)3、NaAlO2 ③Fe、FeCl2、FeCl3 ④NaOH、Na2CO3、NaHCO3 ⑤C、CO、CO2
A. ①②③④⑤ B. ②④ C. ①③⑤ D. ①②④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】糖类、油脂、蛋白质是人类重要的营养物质。下列有关这三类物质的说法正确的是
A.均是天然高分子化合物B.均只由C、H、O三种元素组成
C.油脂的水解反应又叫皂化反应D.淀粉、油脂、蛋白质在一定条件下均能发生水解反应
查看答案和解析>>
科目: 来源: 题型:
【题目】硫单质及其化合物在化工生产、污水处理等领域应用广泛。
(1)煤制得的化工原料气中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
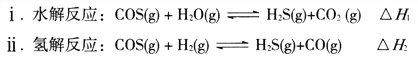
已知反应中相关的化学键键能数据如下表:
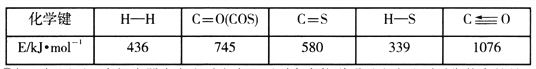
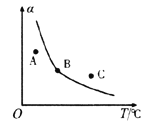
①一定条件下,密闭容器中发生反应i,其中COS(g)的平衡转化率(![]() )与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)
)与温度(T)的关系如图所示。则A、B、C三点对应的状态中,v(COS)=v(H2S)的是____________。(填标号)
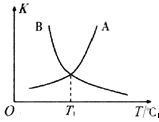
②反应ii的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示逆反应的平衡常数(K逆)的是__________(填“A”或“B”)。T1℃时,向容积为10 L的恒容密闭容器中充入2 mol COS(g)和1 mol H2(g),发生反应ii,COS的平衡转化率为_____________。
(2)过二硫酸是一种强氧化性酸,其结构式为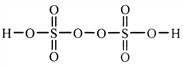
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,该反应的离子方程式为________________________。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液的方法制备过二硫酸铵。总反应的离子方程式为________________________________。
(3)NaHS可用于污水处理的沉淀剂。已知:25℃时,反应Hg2+(aq)+HS-(aq) ![]() HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
①NaHS的电子式为____________________。②Ksp(HgS)=_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢化钙可以作为生氢剂(其中CaH2中氢元素为﹣1价),反应方程式如下:CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是( )
A.既不是氧化剂也不是还原剂
B.是氧化剂
C.是还原剂
D.既是氧化剂又是还原剂
查看答案和解析>>
科目: 来源: 题型:
【题目】根据题目要求回答下列问题:
(1)某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度AgSCN>AgI。
操作步骤 | 现象 |
步骤1:向2 mL 0.005 mol/L AgNO3溶液中加入2 mL 0.005 mol/L KSCN溶液,静置 | 出现白色沉淀 |
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/L Fe(NO3)3溶液 | 溶液变为红色 |
步骤3:向步骤2的溶液中继续加入5滴3 mol/L AgNO3溶液 | 溶液浑浊、红色变浅 |
步骤4:向步骤1余下的浊液中加入5滴3 mol/L KI溶液 | 出现黄色沉淀 |
① 步骤3实验目的是_____________________________。
② 用化学平衡原理解释步骤4中的实验现象:___________________________。
(2)已知:
NH4Cl(s) = NH3(g) + HCl(g) ΔH = +163.9 kJmol-1
HCl(g) + CH3OH(g) = CH3Cl(g) + H2O(g) ΔH = -31.9 kJmol-1
①写出氯化铵和甲醇反应的热化学方程式____________________________,该反应在一定条件下能自发进行的原因是___________________________。
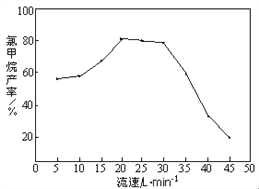
②由下图知,HCl和CH3OH的混合气体通过催化剂时的最佳流速在20 Lmin-1~30 Lmin-1之间。流速过快,会导致氯甲烷产率下降,原因是_________________________。流速过慢,会使副产物二甲醚增多,其反应为2CH3OH → CH3OCH3 + H2O,生产中常通入适量的水蒸气,该操作对制备CH3Cl的影响是___________________________。
(3)某高能锂离子电池充电时,总反应方程式为LiMn2O4=Li1-xMn2O4+xLi。则充电时阳极的电极反应方程式为______________________________________________。若电池的化学能转化为电能时的能量转化率为90%,则当消耗14 g锂时,电路中转移的电子数目为__________NA。
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外活动小组根据镁与CO2的反应设计实验探究镁与NO2的反应。
甲同学推测产物是MgO和N2;
乙同学推测产物除了MgO和N2外,固体中还可能含有Y。
该小组同学设计了以下装置探究镁与NO2反应的固体产物,并测定其组成。
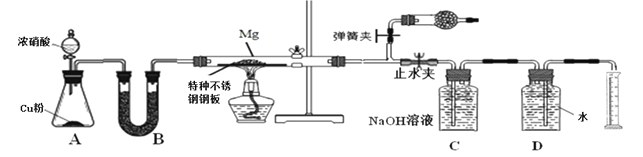
(1)实验开始时,先关闭止水夹后打开弹簧夹,再打开分液漏斗活塞,当硬质玻璃管充满红综色气体后,打开止水夹,关闭弹簧夹,最后点燃酒精灯。这样做的目的是___________________________________________________________
(2)装置B中的试剂可以选用________
A、浓硫酸 B、无水氯化钙 C、五氧化二磷 D、碱石灰
(3)装置C中盛装氢氧化钠溶液的作用是:___________________________________
(4)为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是①气体恢复至室温再读数;②_______________________________;③______________________________。
(5)实验结束后,同学们将固体产物取出与水反应,发现有刺激性气味的气体产生,该气体能使湿润的石蕊试纸变蓝。说明乙组同学推测正确,请写出Y与水反应的化学方程式__________________________________
(6)若初始加入镁粉质量为3.6 g,在足量的NO2中充分反应后 ,收集到N2体积为448mL (标准状况),则产物中MgO的质量是_________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验,不能说明乙酸是弱电解质的是
A. 常温时,测得乙酸钠溶液的pH>7
B. 常温时,测得0.1 mol·L-1乙酸溶液的pH约为3
C. 乙酸溶液与大理石反应产生气泡
D. 相同温度下,测得同物质的量浓度的乙酸溶液的导电性比盐酸溶液弱
查看答案和解析>>
科目: 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用 0.100 mol·L-1 的 NaOH 溶液滴定 10.00 mL 浓度均为 0.100 mol·L-1 的盐酸和 CH3COOH 溶液。利用传感器测得滴定过程中溶液的电导 率如图所示。下列说法正确的是( )

A. 曲线①代表滴定 HCl 溶液的曲线
B. A 点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1
C. 在相同温度下,A、B、C 三点溶液中水的电离程度:C<B=A
D. D 点溶液中:c(Cl-)=2c(OH-)-2c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.1molL﹣1的CH3COOH溶液滴定20mL 0.1molL﹣1的NaOH溶液,当滴加VmLCH3COOH溶液时,混合溶液的pH=7.已知CH3COOH的电离平衡常数为Ka,忽略混合时溶液体积的变化,下列关系式正确是( )
A.Ka=![]() B.V=
B.V=![]()
C.Ka=![]() D.Ka=
D.Ka=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com