
科目: 来源: 题型:
【题目】已知A为金属单质,它们之间能发生如下反应(部分产物未标出)。
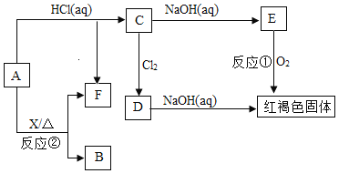
请根据以上信息回答下列问题:
(1)写出物质B的化学式:________。
(2)写出下列反应的化学方程式:
反应①______________________________________。
反应②_______________________________________。
(3)写出下列反应的离子方程式:反应C→D________________________。
(4)检验D中阳离子的方法:_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将3mol/L NaOH溶液滴入到25mL一定浓度的AlCl3溶液中。下图是整个过程的数学分析曲线。其中横轴表示加入OH-的物质的量,纵轴表示产生的Al(OH)3沉淀的物质的量。据图回答:
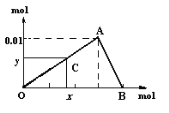
(1)OA曲线表示的离子反应是:__________________________;由此可得A点时加入氢氧化钠溶液的体积为____________;
(2)AB曲线表示的离子反应为:___________,由此可得B点的坐标为:_______。
(3)由上述分析,可求得AlCl3溶液中Al3+离子的浓度为:____mol/L。
(4)当x=0.035时,铝元素在体系中的存在形式为________,其物质的量为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向100mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法不正确的是
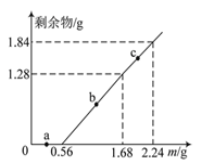
A. a点时溶液中阳离子为Cu2+、Fe2+和Fe3+
B. b点时溶液中发生的反应为:Fe+Cu2+=Cu+Fe2+
C. c点时溶液中溶质的物质的量浓度为0.5 mol·L-1
D. 原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】抗高血压药物洛沙坦是一种结构复杂的有机物,H是合成洛沙坦的一种中间体,其合成路线如下:

已知:I.
II. 酯和醇可发生如下交换反应:
(1)有机物H中含氧官能团的名称是_________。
(2)C![]() D 的反应类型是_________。
D 的反应类型是_________。
(3)A是饱和一元醇,A![]() B反应的化学方程式为_________。
B反应的化学方程式为_________。
(4)1 mol E水解生成2 mol CH3OH,E的结构简式是__________。
(5)E跟乙二醇在一定条件下能够发生反应生成聚合物,写出此反应的化学方程式_________。
(6)通过多步反应,将E分子中引入-NH2可得到F,F分子存在较好的对称关系,F的结构简式是_________。
(7)下列说法正确的是_______。(填字母)
a.A能发生取代反应、氧化反应、消去反应
b.1 mol H与足量的银氨溶液反应,能生成1 mol Ag
c.已知烯醇式结构![]() 不稳定,而G却可以稳定存在,其原因可能是由于基团间的相互影响
不稳定,而G却可以稳定存在,其原因可能是由于基团间的相互影响
(8)写出同时满足下列条件的F的一种同分异构体的结构简式_________。
a.与F具有相同种类和个数的官能团
b.能发生银镜反应
c.其核磁共振氢谱显示有四种不同化学环境的氢,峰面积比为2∶4∶1∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】Fe 和 Fe2O3 的混合物共 27.2g,加入 200mL 稀 H2SO4,在标准状况下收集到 2.24LH2,Fe和 Fe2O3 均无剩余。为中和过量的 H2SO4,并使 Fe 元素全部转化为 Fe(OH)2 沉淀,消耗了 400mL 3mol/L 的 NaOH 溶液,则该 H2SO4 的物质的量浓度为
A. 3mol/L B. 2.25mol/L C. 2mol/L D. 0.5mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4工艺流程如下:
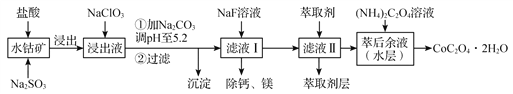
已知:
①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下Co3+的氧化能力很强。
③部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将还原_________(填离子符号)。
(2)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是:___________________________________________。
(3)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。当加入过量NaF后,所得滤液c(Mg2+)/ c (Ca2+)=______________________。【 已知:Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.00×10-10】
(4)已知:NH3·H2O![]()
![]() +OH Kb=1.8×105;
+OH Kb=1.8×105;
H2C2O4![]() H++
H++![]() Ka1=5.4×102;
Ka1=5.4×102;
![]() H++
H++![]() Ka2=5.4×105。
Ka2=5.4×105。
所用(NH4)2C2O4溶液中离子浓度由大到小的顺序为______________________。
(5)
查看答案和解析>>
科目: 来源: 题型:
【题目】钢铁发生析氢腐蚀时,正极上发生的电极反应是
A. 2H++2e-=H2↑ B. Fe2++2e-=Fe
C. 2H2O+O2+4e-=4OH- D. Fe3++e-=Fe2+
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下向10 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。

(1)a点(横坐标为10)所示溶液中离子浓度从大到小的顺序为___________________ ,其中c(Na+)______c(A-)+c(HA)(填“>”“<”或“=”)。
(2)c点所示溶液中,c(Na+)_____c(A-)(填“>”“<”或“=”)。
(3)b点所示溶液中,c(A-)_____c(HA)(填“>”“<”或“=”)。
(4)a、b、c点所示溶液中,水的电离程度最大的是__________________________。
(5)以下滴定操作会导致V(HA)偏大的是____________。
A、滴定管滴定前有气泡,滴定后气泡消失
B、锥形瓶洗涤后没有干燥
C、滴定时锥形瓶中有液体溅出
D、滴定开始前读数时平视,滴定终点,读数时俯视
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于电解精炼铜的说法中不正确的是
A. 电解质溶液中要含有Cu2+
B. 粗铜作阳极,精铜作阴极
C. 电解时,阳极发生氧化反应,阴极发生还原反应
D. 粗铜中所含Zn、Fe、Ni等杂质电解后以单质形式沉枳于阳极泥中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com