
科目: 来源: 题型:
【题目】一定条件下的恒温恒容密闭容器中发生反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L。则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L。则下列判断正确的是
A. c1:c2=1:2 B. 平衡时,Y和Z的生成速率之比为2:3
C. 若反应正向进行,X、Y的转化率不相等 D. c1的取值范围为0<c1<0.14mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,体积相同、pH相同的HCl溶液和CH3COOH溶液,与NaOH溶液中和时两者消耗NaOH的物质的量
A. 相同 B. 中和HCl的多
C. 中和CH3COOH的多 D. 无法比较
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1;将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)![]() CuSO4(s) +5H2O(
CuSO4(s) +5H2O(![]() ),热效应为ΔH3。则下列判断正确的是
),热效应为ΔH3。则下列判断正确的是
A. ΔH2>ΔH3 B. ΔH1<ΔH3
C. ΔH1+ΔH3=ΔH2 D. ΔH1+ΔH2=ΔH3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是:
A. 工业上冶炼铁加入焦炭,目的是利用炭将金属铁从氧化物中还原出来
B. 工业制玻璃和炼铁过程中都要加入石灰石,目的是除去杂质二氧化硅
C. 工业上用金属钠与TiCl4溶液在高温下反应,目的是将金属钛从氯化物中置换出来
D. 海水中提取镁的过程中加入贝壳煅烧制得的石灰,目的是将Mg2+转变成Mg(OH)2
查看答案和解析>>
科目: 来源: 题型:
【题目】向5 mL NaCl溶液中滴入一滴AgN03溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系为
A. AgCl=AgI=Ag2S B. AgCl<AgI<Ag2S
C. AgI>AgCl>Ag2S D. AgCl>AgI>Ag2S
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为利用肼(N2H4)一空气燃料电池电解硫酸铜溶液的示意图。下列说法正确的是( )
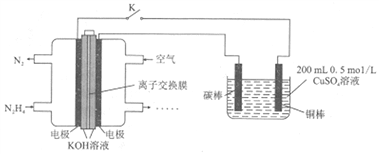
A. 左图中离子交换膜为阳离子交换膜
B. 左图负极反应式为:N2H4-6e-+4OH-=N2↑+4H2O
C. 闭合开关K一段时间后,左图电池中电解质溶液的pH不变
D. 当右图阴极上析出4.48L气体(标准状况)时,消耗0.15molN2H4
查看答案和解析>>
科目: 来源: 题型:
【题目】可以证明可逆反应N2(g)+3H2(g)![]() 2NH3(g)已达到平衡状态的是
2NH3(g)已达到平衡状态的是
①1个N![]() N键断裂的同时,有3个H-H键断裂 ②1个N
N键断裂的同时,有3个H-H键断裂 ②1个N![]() N键断裂的同时,有6个N-H键断裂 ③其他条件不变时,混合气体平均相对分子质量不再改变 ④恒温恒容时,体系压强不再改变 ⑤NH3、N2、H2的体积分数都不再改变 ⑥恒温恒容时,混合气体的密度保持不变 ⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
N键断裂的同时,有6个N-H键断裂 ③其他条件不变时,混合气体平均相对分子质量不再改变 ④恒温恒容时,体系压强不再改变 ⑤NH3、N2、H2的体积分数都不再改变 ⑥恒温恒容时,混合气体的密度保持不变 ⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
A. 全部 B. ②③④⑤ C. ②③④⑤⑦ D. ③⑤⑥⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】在KCl、MgCl2、Mg(NO3)2形成的混合溶液中,c(K+)=0.1mol/L,c(Mg2+)=0.15mol/L,c(Cl﹣)=0.2mol/L,则c(NO3﹣)为( )
A.0.05 mol/L
B.0.20 mol/L
C.0.30 mol/L
D.0.40 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】有一含 NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是_________________。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是______________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为______________________、_______________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①如果实验中没有E装置,则会导致测量结果NaHCO3的质量________(填“偏大”、“偏小”或“无影响”)。
②若样品质量为w g,反应后C、D装置增加的质量分别为m1 g、m2 g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g)![]() 2NO2(g) ΔH=+24.4 kJ/mol。
2NO2(g) ΔH=+24.4 kJ/mol。
(1)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是 _________。
a.v正(N2O4)=2v逆(NO2)
b.体系颜色不变
c.气体平均相对分子质量不变
d.气体密度不变
达到平衡后,保持体积不变升高温度,再次到达平衡时,混合气体颜色____(填 “变深”“变浅”或“不变”),判断理由_______。
(2)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数[例如:p(NO2)=p总×x(NO2)]。写出上述反应平衡常数Kp表达式 _______________________(用p总、各气体物质的量分数x表示);影响Kp的因素_________________。
(3)上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则Kp为____(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×104 s-1,当N2O4分解10%时,v正=______________kPa·s-1。
(4)真空密闭容器中放入一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N2O4分解百分率为α。保持温度不变,向密闭容器中充入等量N2O4,维持总压强在2p0条件下分解,则N2O4的平衡分解率的表达式为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com