
科目: 来源: 题型:
【题目】ClO2是一种高效水处理剂,实验室通过以下反应制得ClO2: 2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O,关于此反应的说法正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O,关于此反应的说法正确的是
A. KClO3发生化合价降低,失电子
B. 反应中H2SO4体现了酸性和强氧化性
C. 反应中H2C2O4被氧化
D. 产物中Cl与C化合价相同,因而氧化性一样强
查看答案和解析>>
科目: 来源: 题型:
【题目】“绿水青山就是金山银山”,下列做法有利于环境保护和可持续发展的是( )
A.大量生产一次性超薄塑料袋方便日常生活
B.对所有垃圾以直接露天焚烧的方式进行处理
C.加大农药和化肥的生产和使用量,以提高粮食的产量
D.推行绿色设计、绿色工艺、开发绿色产品,从源头上消除污染
查看答案和解析>>
科目: 来源: 题型:
【题目】CoC2O4是制备金属钴的原料。利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下:
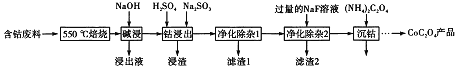
(1)“500℃煅烧”的目的是_______。
(2)“浸出液”的主要成分是_______。
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_________。
(4)“净化除杂1”过程中,需在40~50℃ 加入H2O2溶液,其目的是_____________。
(用离子方程式表示);再升温至80~85℃,加入Na2CO3溶液,调pH至5,“滤渣I”的主要成分是___________。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×10-5mol/L,则c(Mg2+)为________[已知Ksp(MgF2)=7.35×10-11”、 Ksp(CaF2)=1.05×10-10]
(6)为测定制得的CoC2O4产品的纯度,现称取1.00g样品,将其用适当试剂转化为草酸铵[(NH4)2C2O4〕溶液,再用过量稀硫酸酸化,用0.1000mol/L高锰酸钾溶液滴定,当_________时,即达到滴定终点,共用去高锰酸钾溶液26.00mL,该产品的纯度为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】卡托普利是治疗各种原发性高血压的药物,其以乙烯为主要原料合成路线如下:

已知:R1-CHO+![]()
![]()
![]() (R1、R2代表氢原子或烃基)。
(R1、R2代表氢原子或烃基)。
回答下列问题:
(1)E的名称为________________。
(2)反应④的类型为________________。
(3)反应③的条件为________________。
(4)有机物H与F互为同系物(![]() 是与酯基相似的官能团),但比F少一个碳原子,其中核磁共振氢谱有三组峰,且峰面积比为6∶1∶1的所有可能的结构简式为________________。
是与酯基相似的官能团),但比F少一个碳原子,其中核磁共振氢谱有三组峰,且峰面积比为6∶1∶1的所有可能的结构简式为________________。
(5)写出A与新制氢氧化铜悬浊液反应的化学方程式________________。
(6)写出以物质B和乙醛为主要原料制备![]() 的合成路线(无机试剂任选)______。
的合成路线(无机试剂任选)______。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物在工农业生产、生活中有着重要应用。
(1)氯胺[NH2Cl(g)]是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,试写出其杀菌过程中与水反应的化学方程式________________。
(2)羟胺(NH2OH)是有机合成的常见还原剂。工业上可用硝酸.硫酸水溶液作电解质进行电解,在汞电极上NO3-可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式为________________。
(3)银氨溶液是检验醛基的重要试剂,其溶液中存在Ag(NH3)2+(aq)![]() Ag+(aq)+2NH3(aq)。常温下,反应AgCl(s)+2NH3(aq)
Ag+(aq)+2NH3(aq)。常温下,反应AgCl(s)+2NH3(aq)![]() Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=1.94×10-3,且Ksp(AgCl)=1.76×10-10,则K[Ag(NH3)2+]=________________。
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=1.94×10-3,且Ksp(AgCl)=1.76×10-10,则K[Ag(NH3)2+]=________________。
(4)水合肼(N2H4·H2O)常用作锅炉水的除氧剂。N2H4·H2O为二元弱碱,在水溶液中的一级电离方程式表示为N2H4·H2O![]() N2H5++OH-。盐酸肼(N2H6Cl2)是一种可溶性盐,其第一步水解的离子方程式为________________,溶液中离子浓度由大到小的排列顺序为________________。
N2H5++OH-。盐酸肼(N2H6Cl2)是一种可溶性盐,其第一步水解的离子方程式为________________,溶液中离子浓度由大到小的排列顺序为________________。
(5)氨是一种重要的氮肥。工业合成氨反应为:![]() N2(g)+
N2(g)+ ![]() H2(g)
H2(g)![]() NH3(g),该反应的活化能Ea1=254kJ/mol。
NH3(g),该反应的活化能Ea1=254kJ/mol。
①查阅文献,相关化学键键能数据如下:
化学键 | H-H | N | N-H |
E/kJ·mol-1 | 436 | 946 | 391 |
则反应NH3(g)![]()
![]() N2(g)+
N2(g)+ ![]() H2(g)的活化能Ea2=________________。
H2(g)的活化能Ea2=________________。
②一定条件下,1molN2与3.6molH2在密闭容器中充分反应,测得放出的热量为13.8kJ,则H2的转化率为________________,为提高原料的利用率,工业合成氨应该采取的措施是=________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利尿酸在奥运会上被禁用,其结构简式如下图所示。下列叙述正确的是

A. 利尿酸衍生物利尿酸甲酯的分子式是C14H14Cl2O4
B. 利尿酸分子内处于同一平面的碳原子最多有10个
C. 1mol利尿酸能与6molH2发生加成反应
D. 利尿酸能与FeCl3溶液发生显色反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com