
科目: 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2-、碳氢化合物大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:汽车尾气中的CO、NOx、碳氮化合物是大气污染物。使用稀土等催化剂能将CO、NO转化成无毒物质。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol K1(该反应的平衡常数)
2C(s)+O2(g)=2CO(g) △H2=-221kJ/mol K2(同上)
C(s)+O2(g)=CO2(g) △H3=-393.5kJ/mol K3(同上)
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式_________,以及该热化学方程式的平衡常数K=________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2 △H=-1200kJ/mol。
4CO2+N2 △H=-1200kJ/mol。
①某温度下,在2L密闭容器中充入0.lmolNO和02m1CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的29/30,则反应开始到平衡时NO2的平均反应速率v(NO2)=_________mol/(L·s)。
②若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为1mol/L、0.4mol/L、0.lmol/L、amol/L,要使反应向逆反应方向进行,a的取值范围_________。
③能使该反应的反应速率增大,且平衡向逆反应方向移动的是_______。
A.及时分离出CO2 B.适当升高温度
C.减小容器体积使体系压强增大 D.选择高效催化剂
(3)电化学降解NO2-的原理如下图:
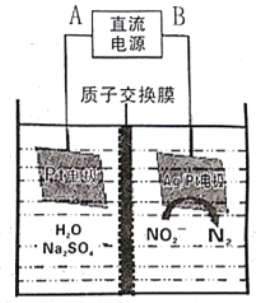
①电源的正极是___(填A或B),阴极反应式为___________。
②若电解过程中转移了3mol电子,则膜两侧电解液的质量变化差![]() 为______g。
为______g。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验现象描述正确的是( )
选项 | 实 验 | 现 象 |
A | 向饱和Na2CO3溶液中通入足量的CO2气体 | 无明显现象 |
B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝箔滴落下来 |
C | 向久置于空气中的FeSO4溶液中滴加NaOH溶液 | 立刻产生大量白色沉淀 |
D | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时火焰为黄色,燃烧后生成淡黄色固体 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时H2A的pKa1=1.85;pKa2=7.19。常温下,用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2A溶液的滴定曲线如右图所示(曲线上的数字为pH)。下列说法正确的是

A. a点所得溶液中c(HA)+c(A2-)+c(HA-)=0.1mol/L
B. b点所得溶液中:c(H2A)+2c(H+)=c(A2-)+2c(OH-)
C. 对应溶液水的电离程度:a>b>c>d
D. C点所得溶液中:c(Na+)>3c(HA-)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.1mol·L-1HF溶液中加入0.1 mol CaCl2固体(不考虑溶液体积变化),则下列说法中错误的是
A. 原HF溶液c(H+)约为6×10-3mol·L-1
B. 加入 CaCl2后溶液中有CaF2沉淀产生
C. 加入CaCl2后溶液中的c(H+)浓度不变
D. 2HF(aq)+Ca2+(aq)=CaF2(s)+2H+(aq)的平衡常数为K=8.88×102
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 实验室用氯化铁溶液制取氢氧化铁胶体:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
B. 碳酸钙溶于醋酸:CaCO3+2H+ ═Ca2++H2O+CO2↑
C. 铝和烧碱溶液:2Al+2OH-+2H2O═2Al3++3H2↑
D. AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】元素W、X、Y、Z的原子序数依次增加,p、q、r是由这些元素组成的二元化合物;m、n分别是元素Y、Z的单质,m是常见的金属单质,n通常为深红棕色液体;0.01mol/Lr溶液的pH为2,p被英国科学家法拉第称为“氢的重碳化合物”,s通常是难溶于水、比水重的油状液体。上述物质的转化关系如图所示。下列说法错误的是

A. q的溶液显酸性 B. W的氧化物常温常压下为液态
C. Z的氧化物的水化物一定为强酸 D. p不能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物是我们熟悉的典型非金属元素,研究它们的性质对于生产、生活、科研具有重要意义,请回答以下问题:
I.(1)图为制取氨气的装置和选用的试剂,其中错误的是______.(填字母)
A.①② B.②③ C.③④ D.①③

(2)实验室制备氨气的化学反应方程式是_______________________________________为了得到干燥的 NH3,可用_______做干燥剂。若有5.35g氯化铵参加反应,则产生的气体在标准状况下的体积为______L.
II.铵盐受热易分解,如图所示

(1)被加热的铂丝处发生反应的化学方程式为_______________________________.
(2)B中出现的现象为___________________________.
(3)烧杯C中发生反应可得到酸X,如图:足量X的浓溶液与Cu反应,写出烧瓶中发生反应的离子方程式______________________.

(4)实验完毕后,试管中收集到的气体的主要成分为______(写化学式).
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,将pH=12的NaOH溶液平均分成两份,一份加水V1 L,另一份加入与该NaOH溶液物质的量浓度相等的硫酸V2 L,pH都降低了1,则V1 :V2 为(溶液体积可以叠加)
A. 10 : 1 B. 11 : 1 C. 20 : 1 D. 21 : 1
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,对于pH=11的氨水,下列判断正确的是
A. 该氨水的浓度为1.0×10-3mol·L-1
B. 加水稀释,溶液中所有离子的浓度均减小
C. 加水稀释,溶液中c(NH4+)/c(NH3·H2O)变大
D. 与pH=3的盐酸等体积混合,反应后溶液pH=7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com