
科目: 来源: 题型:
【题目】硼及其化合物在耐高温合金工业、催化剂制造、高能燃料等方面有广泛应用。
(1)硼基态原子的电子排布式为_____。硼和铝可分别形成[BF4]-和[AlF6]3-,[BF4]-的空间构型为___,硼元素不可能形成[BF6]3-的原因是________________。
(2)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造。由第二周期元素组成的与BCl3互为等电子体的阴离子为________,该阴离子的中心原子杂化方式为_________。
(3)氨硼烷(H3N→BH3)和Ti(BH4)3均为广受关注的新型储氢材料。
①B与N的电负性:B______N(填“>”“<”或“=”,下同)。
②Ti(BH4)3由TiCl3和LiBH4反应制得。写出制备反应的化学方程式:_________。
(4)磷化硼(BP)是受到高度关注的耐磨材料,它可用作金属表面的保护层。如图为磷化硼晶胞。
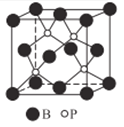
①磷化硼晶体属于______晶体(填晶体类型),是否含有配位键? _____ (填“是”或“否”)
②晶体中P原子的配位数为_____。
③已知BP的晶胞边长为anm,NA为阿伏加德罗常数的数值,则磷化硼晶体的密度为_____g·cm-3(用含a、NA的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组用下图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
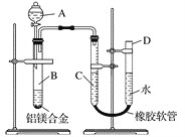
(1)A中试剂为________。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是___________。
(3)将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤、洗涤、干燥、称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;⑤检查气密性,上述操作的顺序是___________ (填序号);记录C的液面位置时,除视线平视外,还应__________。
(4)若实验用铝镁合金的质量为ag,测得氢气体积为bmL(已换算为标准状况),B中剩余固体的质量为cg,则铝的相对原子质量为________。
(5)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将________(填“偏大”“偏小”或“不受影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】有NaCl、NaOH、AgNO3三种溶液,只用一种试剂就可把它们鉴别开来,该试剂是( )
A.FeCl3溶液
B.Na2CO3溶液
C.MgCl2溶液
D.盐酸
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.加热杀死流感H7N9病毒是因为蛋白质受热发生盐析
B.医用酒精灭活新冠肺炎病毒是利用其氧化性
C.我国研制的重组新冠疫苗无需冷藏保存
D.乙烯的产量通常用来衡量一个国家石油化工的水平
查看答案和解析>>
科目: 来源: 题型:
【题目】能源是人类生存、社会发展不可或缺的物质,CO、H2、CH3OH均是重要的能源物质。
(1)已知:氧气中化学键的键能为497kJ/mol,二氧化碳中C=O键的键能为745kJ/mol。
2CO(g)+O2(g)=2CO2(g) △H1=-566kJ/mol
H2O(g)+CO(g)=H2(g)+CO2(g) △H2=-41kJ/mol
CH3OH(g)+![]() O2(g)==CO2(g)+2H2O(g) △H3=-660kJ/mol
O2(g)==CO2(g)+2H2O(g) △H3=-660kJ/mol
CO(g)+2H2(g)![]() CH3OH(g) △H4
CH3OH(g) △H4
则使1molCO(g)完全分解成原子所需要的能量至少为___,△H4=___。
(2)某密闭容器中存在反应:CO(g)+2H2(g)![]() CH3OH(g),起始时容器中只有amol/LCO和bmol/LH2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
CH3OH(g),起始时容器中只有amol/LCO和bmol/LH2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
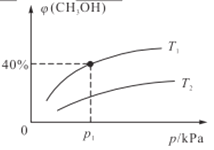
①温度T1和T2时对应的平衡常数分别为K1、K2,则K1____K2(填“>”“<”“=”);若恒温(T1)恒容条件下,起始时a=1、b=2,测得平衡时混合气体的压强为p1kPa,则T1时该反应的压强平衡常数Kp=___。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,用含p1的代数式表示)
②若恒温恒容条件下,起始时充入1molCO和2molH2,达平衡后,CO的转化率为α1,此时,若再充入1molCO和2molH2,再次达平衡后,CO的转化率为α2,则α1_____α2 (填“>”“<”“=”“无法确定”)
③若恒温恒容条件下,起始时a=1、b=2,则下列叙述能说明反应达到化学平衡状态的是____。
A.CO、H2的物质的量浓度之比为1:2,且不再随时间的变化而变化
B.混合气体的密度不再随时间的变化而变化
C.混合气体的平均摩尔质量不再随时间的变化而变化
D.若将容器改为绝热恒容容器时,平衡常数K不随时间变化而变化
(3)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体CO2,其产物之一是NH4HCO3。已知常温下碳酸的电离常数K1=4.4×10-7、K2=4.7×10-11,NH3·H2O的电离常数K=1.8×10-5,则所得到的NH4HCO3溶液中c(NH4+)_____c(HCO3-)(填“>”“<”“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】为除去粗盐中的钙离子、镁离子、硫酸根离子及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)第①步中,操作A是__________,第⑤步中,操作B是__________。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为氯化钙)____________________________。
(3)若先用盐酸调溶液至中性,再过滤,将对实验结果产生影响,其原因是_________________________。
(4)判断氯化钡已过量的方法是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)如图甲所示为二维平面晶体示意图,化学式表示为AX3的是________。
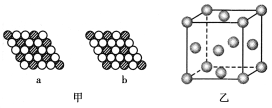
(2)图乙为一个金属铜的晶胞,请完成以下各题:
①该晶胞“实际”拥有的铜原子数是________个;
②该晶胞称为________(填序号);
A.六方晶胞 B.体心立方晶胞 C.面心立方晶胞
③此晶胞立方体的边长为a cm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则阿伏加德罗常数为________(用aρ表示)。
(3)《X射线金相学》中记载关于铜与金可形成两种有序的金属互化物,其结构如下图所示。下列有关说法正确的是________。
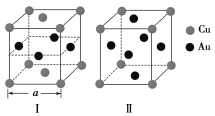
A.图Ⅰ、Ⅱ中物质的化学式相同
B.图Ⅱ中物质的化学式为CuAu3
C.图Ⅱ中与每个铜原子紧邻的铜原子有3个
D.设图Ⅰ中晶胞的边长为a cm,则图Ⅰ中合金的密度为![]() g·cm-3
g·cm-3
查看答案和解析>>
科目: 来源: 题型:
【题目】如右图所示为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单元。
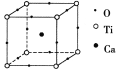
(1)在该物质的晶体结构中,每个钛离子周围与它最近且距离相等的钛离子、钙离子各有__________个、__________个。
(2)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构如图中正方体边长(钛原子之间的距离)为d nm(1 nm=1×10-9 m),则该晶体的密度为__________g/cm3(阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:
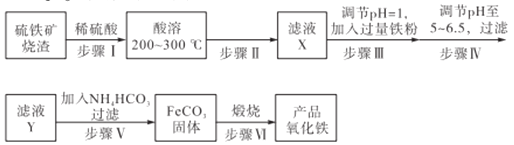
试回答下列问题:
(1)实验室实现“步骤II”中分离操作所用的玻璃仪器有____、玻璃棒和烧杯等;该步骤是为了除去_______(填相关物质的化学式)。
(2)检验步骤III已经进行完全的操作是_______________________。
(3)步骤V的反应温度一般需控制在35℃以下,其目的是______________;该步骤中反应生成FeCO3的离子反应方程式为___________。
(4)步骤VI中发生反应的化学反应方程式为____________________。
(5)步骤V中,FeCO3达到沉淀溶解平衡时,若c(Fe2+)=1×10-6mol/L,欲使所得的FeCO3中不含有Fe(OH)2,应控制溶液的pH≤_____(已知:Ksp[Fe(OH)2]=4.9×10-17,lg7=0.8)。
(6)欲测定硫铁矿矿渣中Fe元素的质量分数,称取ag样品,充分“酸溶” “水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg,测得该样品中Fe元素的质量分数为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com