
科目: 来源: 题型:
【题目】某溶液中存在5种离子:NO3-、SO42-、Fe3+、H+和R离子,其物质的量之比为2:3:1:3:1,则R可能为
A. Ca2+ B. Mg2+ C. Cl- D. Ba2+
查看答案和解析>>
科目: 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
I.己知某些化学键的键能数据如下:
化学键 | C=O | C-O | C-H | H-H | O-H |
键能/kJ·mol-1 | a | b | c | d | e |
(1)CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=____kJ/mol(用字母表示)。
CH3OH(g)+H2O(g) △H=____kJ/mol(用字母表示)。
II.将燃煤废气中的CO 转化为二甲醚的反应原理为:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
(2)已知在某压强下,该反应在不同温度、不同投料比时,达平衡时CO2的转化率如下图所示:

①该反应的△H_____0(填“>”或“<”)。
②700K,将4molH2和2molCO2投入2L恒容密闭容器中,反应经3min达到平衡,则CH3OCH3(g)在0~3min内的生成速率为_________。
(3)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,下列物理量不再发生变化时,能说明反应达到平衡状态的是_______。
A.二氧化碳的浓度 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
(4)某温度下,在体积可变的密闭容器中,改变起始时加入各物质的量,在不同的压强下,平衡时CH3OCH3(g)的物质的量如下表所示:
P1 | P2 | P3 | |
I.2.0molCO26.0molH2 | 0.10mol | 0.04mol | 0.02mol |
II.1.0molCH3OCH33.0molH2O | X1 | Y1 | Z1 |
①P3______P2(填“>”、“<”或“”);
②P2下,I中CH3OCH3的平衡转化率为_______。
III.在一定条件下,CO2(g)+H2(g)![]() CO(g)+H2O(g)。
CO(g)+H2O(g)。
(5)在1L密闭容器中若CO2(g)、H2(g)初始投料均为1mol,反应达平衡时CO在平衡混合气中的体积分数为25%,则该温度下该反应的平衡常数K=____。向此容器中再充入CO2(g)、H2(g)各0.5mol,则平衡_______(填“正向移动”、“逆向移动”或“不移动”)。
查看答案和解析>>
科目: 来源: 题型:
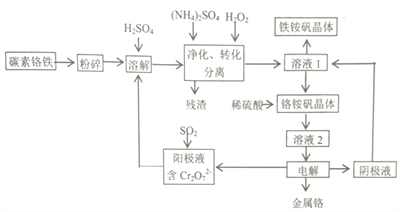
【题目】金属铬在工业上有广泛用途,主要用于不锈钢及高温合金的生产。铬铵矾(NH4Cr(SO4)2·12H2O)法是一种以碳素铬铁(主要是由Cr、Fe、C形成的合金)为主要原料生产金属铬,并能获得副产物铁铵矾【(NH4Cr(SO4)2·12H2O)】的方法。有关流程如下:
己知部分阳离子以氢氧化物开始沉淀和完全沉淀的pH如下表(金属离子浓度为0.01mol/L):
沉淀物 | Fe(OH)2 | Fe(OH)3 | Cr(OH)3 |
开始沉淀的pH | 7.6 | 2.7 | 4.9 |
完全沉淀的pH | 9.6 | 3.7 | 6.8 |
(1)溶解碳素铬铁前需将其粉碎,其目的是____________
(2)净化和转化阶段:所得残渣的主要成分是___________,转化时需要添加定量的H2O2,其目的是__________。由溶液1获得铁铵矾晶体的操作方法为______,过滤、洗涤、干燥。
(3)将铬铵矾晶体溶于稀硫酸,而不是直接溶于水的主要原因是_________________。
(4)阳极液通入SO2的离子反应方程式______________。
(5)工业废水中含有一定量的Cr3+,也含有一定量的Mg2+、Ca2+,而除去“钙、镁”是将其转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF使两种沉淀共存时,溶液中c(Mg2+)/c(Ca2+)=__________。
(6)某课外活动小组将铬铵矾(NH4CrSO4)·12H2O)经过一系列操作获得了Cr2(CO3)3粗品。该小组利用EDTA(乙二胺四乙酸二钠,阴离子简写为H2Y2-)测定粗品中Cr2(CO3)3的质量分数,准确称取2.00g粗品试样,溶于5.0mL稀盐酸中,依次加入5.0mLNH3·NH4Cl缓冲溶液、0.10g紫脲酸铵混合指示剂,用0.100mol/LEDTA标准溶液滴定至呈稳定颜色,平均消耗标准溶液5.00mL已知:Cr3++H2Y2-=CrY+2H+。
①滴定操作中,如果滴定前装有EDIA标准溶液的满定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将_____(填“偏大”、“偏小”或“不变”)。
②粗品中Cr2(CO3)3的质量分数w[Cr2(CO3)3]=____。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知NO和O2转化为NO2的反应机理如下:
①2NO(g)![]() 2N2O2(g)(快) △H1<0 平衡常数K1
2N2O2(g)(快) △H1<0 平衡常数K1
②N2O2(g) +O2(g)![]() 2NO2(g) (慢) △H2<0 平衡常数K2
2NO2(g) (慢) △H2<0 平衡常数K2
下列说法正确的是
A. 反应过程中的能量变化可用图a表示

B. 2NO(g) +O2(g)![]() 2NO2(g)的△H=-(△H1+△H2)
2NO2(g)的△H=-(△H1+△H2)
C. 2NO(g)+O2(g)![]() 2NO2(g)的平衡常数K=K1/K2
2NO2(g)的平衡常数K=K1/K2
D. 反应②的速率大小决定2NO(g)+O2(g)![]() 2NO2(g)的反应速率
2NO2(g)的反应速率
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.01mol/L的氨水溶液中滴加相同浓度的CH3COOH溶液,在滴加过程中溶液的pH与所加醋酸的体积关系如图所示。下列说法错误的是

A. n=7
B. 水的电离程度先增大再减小
C. 常温下,0.01mol/L的氨水溶液中NH3·H2O的电离度为3.98%
D. Y点溶液中c(NH3·H2O)+(OH-)=c(CH3COO-)+c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com