
科目: 来源: 题型:
【题目】下列各溶液中一定能大量共存的离子组是( )
A. 使酚酞溶液呈红色的溶液中:Mg2+、Cu2+、SO![]() 、K+
、K+
B. 使pH试纸呈红色的溶液中:Fe2+、K+、NO![]() 、Cl-
、Cl-
C. c(H+)=10-14 mol·L-1溶液中:Na+、AlO![]() 、S2-、SO
、S2-、SO![]()
D. 水电离出的c(H+)为10-12mol·L-1的溶液中:K+、Na+、CO![]() 、Ca2+
、Ca2+
查看答案和解析>>
科目: 来源: 题型:
【题目】配合物Fe(CO)5的熔点一20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如图所示。

(1)基态Fe原子的价电子排布式是_____________________;Fe(CO)5晶体类型属于__________晶体。
(2)CO分子中C、O原子都满足8电子稳定结构,CO分子的结构式是________,写出与CO互为等电子体的分子的电子式:___________________。
(3)C、O、Fe的第一电离能由大到小的顺序为_______________________。
(4)关于Fe(CO)5,下列说法正确的是______。
A. Fe(CO)5是非极性分子,CO是极性分子 B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键 D.Fe(CO)5==Fe+5CO反应中没有新化学键生成
(5)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如下图所示。

①上述三种晶体的晶胞中属于面心晶胞的是______(填“a”“δ””或“γ”)-Fe。
②a-Fe晶胞中铁原子的配位数为_______________。
③γ-Fe晶胞的边长为apm,则γ-Fe单质的密度为____g/cm3(NA表示阿伏伽德罗常数的值,列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 146 C 和 146 C 是不同种核素,化学性质也不相同
B. H2O 和H2O2 互为同素异形体
C. CH3COOCH2CH3 和 CH3CH2COOCH3 互为同系物
D. CH3CH(CH3)2 的名称叫 2-甲基丙烷,也可以叫做异丁烷
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于钠及其化合物的说法正确的是( )
A.将剩余的金属钠丢弃在废纸篓里
B.小苏打可用于制作糕点的膨松剂,苏打可用于治疗胃酸过多
C.侯氏制碱法的工艺过程中应用了物质溶解度的差异
D.生活中用热的烧碱溶液洗去油污
查看答案和解析>>
科目: 来源: 题型:
【题目】下列能用勒夏特列原理解释的是( )
A. 铁在潮湿的空气中易腐蚀
B. H2、I2、HI平衡混和气加压后颜色变深
C. 往往需要在催化剂条件下SO2氧化成SO3
D. 棕红色NO2加压后颜色先变深后变浅
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)由工业合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,涉及以下四个可逆反应:
甲醇合成反应:
(i)CO(g) +2H2(g)==CH3OH(g) △H 1=-90.1kJ·mol-1;
(ii)CO2(g)+3H2(g)== CH3OH(g) +H2O(g) △H2=-49.0kJ·mol-1;
水煤气变换反应:(iii)CO(g)+ H2O(g)==CO2(g)+ H2(g) △H3=-41.1kJ·mol-1;
二甲醚合成反应:(iv)2CH3OH(g) ==CH3OCH3(g)+ H2O(g) △H4=-24.5kJ·mol-1;
①由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为____________________________。根据化学反应原理,分析增大压强对直接制备二甲醚反应的影响:___________________________________。
②反应( ii )的平衡常数表达式为K=______________。
(2)现以二甲醚燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72-),实验室利用如图2装置模拟该法:

①M电板(a为CO2)的电极反应式为________________________;电解池阳极的电极反应式为_______________________________________。
②请写出电解池中Cr2O72-转化为Cr3+的离子反应方程式:__________________________。
③已知25 ℃时,Ksp[Cr(OH)3]=6.4×10-31。一般以离子浓度≤1×10-5 mol/L作为该离子除尽的标准。处理废水时,最后Cr3+以Cr(OH)3形式除去,当溶液的pH=6时,c(Cr3+)=______,Cr3+ ___ (填“是”或“否”)被除尽。
查看答案和解析>>
科目: 来源: 题型:
【题目】锌铜原电池(如图)工作时,下列叙述正确的是( )

A. 正极反应为Zn-2e-==Zn2+
B. 电池反应为Zn+Cu2+==Zn2++Cu
C. 盐桥中的K+移向ZnSO4溶液
D. 在外电路中,电流从负极流向正极
查看答案和解析>>
科目: 来源: 题型:
【题目】盐酸法是在一定温度下盐酸与铝土矿、高岭土或粉煤灰等固体中的活性Al2O3发生反应制备Al2O3的工艺。氯化铝溶液可通过蒸发结晶生成结晶氯化铝,进而焙烧得到氧化铝;也可利用氯化铝在酸溶液中的溶解度随着盐酸浓度的升高而急剧降低的特点,生成氯化铝晶体,从而焙烧得到氧化铝。图1是我国某公司研发的具有自主知识产权的“一步酸溶法”工艺流程。
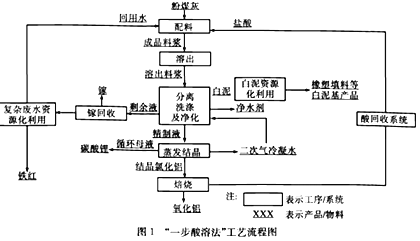
回答下列问题:
(1)“氯化铝在酸溶液中的溶解度随着盐酸浓度的升高而急剧降低”的原因是________________________________________________________(结合必要的化学方程式说明)。
(2)精制液蒸发结晶后分离出纯净结晶氯化铝的操作名称是_______,用_____洗涤。
(3)写出结晶氯化铝(AlCl3·6H2O)焙烧的化学方程式:_____________________________。
(4)工业上冶炼金属铝的方法是电解熔融的_______(填化学式),电解过程中作阳极的石墨易消耗,原因是___________________________。
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com