
科目: 来源: 题型:
【题目】X、Y、Z、R为前四周期原子序数依次增大的元素。X原子有3个能级,且每个能级上的电子数相等;Z原子的不成对电子数在同周期中最多,且Z的气态氢化物在同主族元素的氢化物中沸点最低;X、Y、R三元素在周期表中同族。
(1)R元素在周期表中的位置是_______________________,其基态原子的价层电子排布图为__________________________。
(2)下图表示X、Y、Z的四级电离能变化趋势,其中表示Z的曲线是_________(填标号)。

(3)化合物(XH2=X=O)分子中X原子杂化轨道类型是___________,1mol (X2H5O)3Z=O分子中含有的σ键与π键的数目比为_______________。
(4)Z与氯气反应可生成一种各原子均满足8电子稳定结构的化合物,其分子的空间构型为______。
(5)某R的氧化物晶胞结构如下图所示,该物质的化学式为____________。已知该晶体密度为ρg/cm3,距离最近的两个原子的距离为d pm,则R的相对原子质量为___________________。 (阿伏加德罗常数为NA)

(6)X形成的一种常见单质,性质硬而脆,原因是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中存在5种离子:NO3-、SO42-、Fe3+、H+和R离子,其物质的量之比为2:3:1:3:1,则R可能为
A. Ca2+ B. Mg2+ C. Cl- D. Ba2+
查看答案和解析>>
科目: 来源: 题型:
【题目】能源是人类共同关注的重要问题。页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应 CH4(g)+H2O(g)=CO(g)+3H2(g)△H1
已知:①CH4、H2、CO 的燃烧热(△H)分别为-a kJmol-1、-b kJmol-1、-c kJmol-1;
②H2O (l) =H2O(g); △H=+dkJmol-1
则△H1= ___________(用含字母a、b、c、d的代数式表示)kJmol-1。
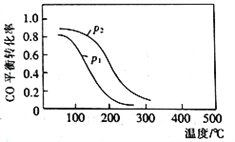
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①△H2_________ (填“>”“<”或“ = ”)0。
②下列说法正确的是____________ (填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③ 03 min内用CH3OH表示的反应速率v(CH3OH)=________mol L-1·min-1。
④ 200℃时,该反应的平衡常数K =_______。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡____________(填“正向”、“逆向”或“不”)移动。
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下通入5.6 L甲烷,测得电路中转移1.2 mol电子,则甲烷的利用率为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为________________________________________________________________________。
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是________________________________________________________________________。
(3)SO![]() 中S以sp3杂化,SO
中S以sp3杂化,SO![]() 的立体构型是________。
的立体构型是________。
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,金原子最外层电子排布式为____________。一种铜合金晶体具有立方最密堆积的结构,在晶胞中铜原子处于面心,金原子处于顶点位置,则该合金中铜原子与金原子数量之比为________;该晶体中,原子之间的作用力是________________________________________________________________________。
(5)CuSO4晶体的构成微粒是________和________,微粒间的作用力是________,该晶体属于________晶体。
(6)上述晶体具有储氢功能,氢原子可进入到由铜原子与金原子构成的四面体空隙中。若将铜原子与金原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式应为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)分析下列物质的物理性质,判断其晶体类型:
A.碳化铝,黄色晶体,熔点2 200℃,熔融态不导电________;
B.溴化铝,无色晶体,熔点98℃,熔融态不导电________;
C.五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中________;
D.溴化钾,无色晶体,熔融时或溶于水中都能导电________。
(2)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX′型卤素互化物与卤素单质结构相似、性质相近。如图是部分卤素单质和XX′型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是________________________________________________________________________。
试推测ICl的沸点所处的最小范围________。

查看答案和解析>>
科目: 来源: 题型:
【题目】黄铁矿石的主要成分为FeS2和少量FeS(假设其它杂质中不含铁、硫元素,且高温下不发生化学变化),它是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为4FeS2+11O2=2Fe2O3+8SO2,4FeS+7O2=2Fe2O3+4SO2
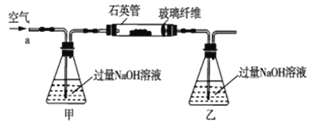
(实验一)测定硫元素的含量
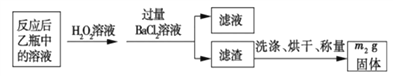
反应结束后,将乙瓶中的溶液进行如下处理:
(1)鼓入空气的作用是_____________________。
(2)反应结束后,给乙瓶溶液中加入足量H2O2溶液的目的是___________(用化学方程式表示)。H2O2可以看成是一种很弱的酸,写出其主要的电离方程式为____________________。
(3)该黄铁砂石中硫元素的质量分数为____________________(列出表达式即可)。
(实验二)测定铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤 ③将过滤液稀释至250mL
④取25.00mL稀释液,用0.100mol·L-1的酸性KMnO4溶液滴定
(4)步骤②中,若用铁粉作还原剂,则所测得的铁元素的含量__________(填“偏大”“ 偏小” 或“无影响”)。
(5)请写出步骤②中洗涤的方法____________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
第一次 | 第二次 | 第三次 | 第四次 | |
消耗KMnO4溶液体积/ml | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度c(Fe2+)=__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验测得不同物质中O—O键的键长和键能数据如下表。其中X、Y的键能数据尚未测定,但可根据规律性推导键能的大小顺序为W>Z>Y>X。
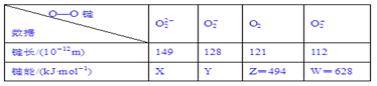
(1)键长与键能的关系规律是_________________________________________。
(2)键长与电子总数的关系规律是______________________________________。
(3)键能与电子总数的关系规律是_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下有:①6.72LCH4,②3.01×1023个HCl分子,③13.6gH2S,④0.2molNH3。下列对这四种气体的描述正确的是( )
a. 体积②>③>①>④ b. 密度②>③>④>①
c. 质量②>③>①>④ d. 氢原子个数①>③>④>②
A. abc B. bcd C. abd D. abcd
查看答案和解析>>
科目: 来源: 题型:
【题目】长期以来一直认为氟的含氧酸不存在,但1971年美国科学家将F2通入细冰沫获得HFO(次氟酸)。
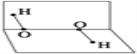
(1)HFO的电子式为________。
(2)HFO与水反应得到物质A(结构如图所示),写出HFO与水反应的化学方程式________________。
(3)分子A中存在________键。A.仅有σ键 B.仅有π键 C.同时含有σ键、π键 D.同时存在极性键和非极性键
查看答案和解析>>
科目: 来源: 题型:
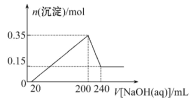
【题目】某研究小组取一定质量的镁铝合金材料投入200 mL稀硫酸中,待固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液体积(V)的关系如图所示。
请回答下列问题:
(1)加入NaOH溶液0~20 mL时,发生反应的离子方程式为__________________________。
(2)加入NaOH溶液体积为220 mL时,沉淀的成分是________________________________。
(3)该合金材料中,镁、铝的物质的量之比为________________________。
(4)稀硫酸的物质的量浓度为__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com