
科目: 来源: 题型:
【题目】A.为了制备氯气,某同学查阅资料发现实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)请用双线桥法对该反应进行标注________________。
(2)写出该反应的离子方程式________________。
(3)该反应中,氧化剂和还原剂之比是_________。
(4)草酸能使酸性KMnO4溶液褪色,配平下面的化学方程式:
_____KMnO4+____H2SO4+____H2C2O4 = ____MnSO4+_____K2SO4 +____CO2↑+____H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1价和+2价的化合物。
(1)写出基态Cu+的核外电子排布式___________________________________。
(2)如图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为________。

(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀,该物质中的NH3通过________键与中心离子Cu2+结合,NH3分子中N原子的杂化方式是____。与NH3分子互为等电子体的一种微粒是________。
(4)CuO的熔点比CuCl的熔点____(填“高”或“低”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Y、Z、W、R、M五种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,有如下信息:
元素 | 相关信息 |
Y | 原子核外有6个不同运动状态的电子 |
Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
W | 主族元素,与Z原子的价电子数相同 |
R | 价层电子排布式为3d64s2 |
M | IB族,其被称作“电器工业的主角” |
请回答下列问题(Y、Z、W、R、M用所对应的元素符号表示):
(1)Z、W元素相比,第一电离能较大的是_____________________,M2+的核外电子排布式为________________________。
(2)M2Z的熔点比M2W的_________(填“高”或“低”) ,请解释原因___________ 。
(3)N3-和YZ2是等电子体,则N3-的结构式为_________________ 。
(4)WZ2分子中W原子价层电子对数是_____________对,WZ2的VSEPR 模型名称为______________________,WZ3气态为单分子,该分子中W原子的杂化轨道类型为__________________;WZ3的三聚体环状结构如图1所示,该结构中W原子的杂化轨道类型为__________;该结构中W-Z键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为___________(填图2中字母) ,该分子中含有___个σ键。
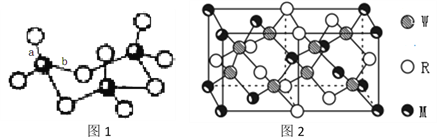
(5)MRW2的晶胞如图2所示,晶胞参数a=0.524nm、c=1.032nm;MRW2的晶胞中每个M原子与_______个W原子相连,晶体密度ρ=_______g/cm3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA=6.02×1023mol-1)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列电离方程式书写正确的是( )
A.FeCl3 == Fe3+ + Cl3—
B.H2SO4 == 2H+ + SO42-
C.NaOH == Na+ + O2- + H+
D.Ca(NO3)2 == Ca2+ + 2(NO3)2-
查看答案和解析>>
科目: 来源: 题型:
【题目】三水乳酸亚铁晶体[(CH3CHOHCOO)2Fe3H2O,Mr=288]是一种很好的补铁剂,易溶于水,吸收效果比无机铁好。可由绿矾(FeSO4·7H2O)通过下列反应制备:
FeSO4+Na2CO3== FeCO3↓+Na2SO4
FeCO3+ 2CH3CHOHCOOH ==(CH3CHOHCOO)2Fe+CO2↑+H2O
(1)制备FeCO3时,选用的加料方式是______(填字母),原因是_______________________。
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是__________________。
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75℃下搅拌反应。
①铁粉的作用是_____________________。
②反应结束后,无需过滤,除去过量铁粉的方法及反应方程式是______________________________________。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得三水乳酸亚铁晶体。分离过程中加入无水乙醇的目的是_______________。
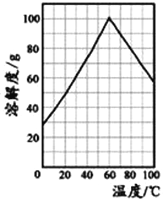
(5)某研究性学习小组从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3) 出发,经过一系列的实验步骤,最后制得到了硫酸亚铁溶液。请结合如图的绿矾溶解度曲线,将FeSO4溶液____________,得到FeSO4·7H2O晶体。
(6)该兴趣小组用标准KMnO4溶液测定产品中亚铁含量进而计算乳酸亚铁晶体的质量分数,发现产品的质量分数总是大于100%,其原因可能是____________________。经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量。取2.880g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.1000molL-1Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)219.7mL。滴定反应为Ce4++Fe2+═Ce3++Fe3+,则产品中乳酸亚铁晶体的质量分数为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国核电技术居于世界前列。从铀矿石中提取核燃料的过程中,UO3可用酸性浸出剂或碱性浸出剂转化成铀氧基离子UO22+的化合物。

(1)写出硫酸酸浸时的化学方程式__________________________,为了提高浸出率,可采取的措施是__________________(写两条)。
(2)MnO2的作用是在酸性条件下将Fe3+氧化UO2形成的Fe2+迅速氧化成Fe3+,使Fe3+继续氧化UO2。写出这两步的离子方程式__________________,__________________。当溶液中Fe3+的浓度达到1~2g/L时就能有效地溶解UO2,此时Fe3+的物质的量浓度范围相当于______________。
(3)UO3用碳酸钠溶液碱法浸取时生成[UO2(CO3)3]4-离子,写出该浸出化学反应方程式_________________________________。
(4)已知:HCN的电离常数Ka=4.9×10-10,H2S的电离常数Ka1=1.3×10-7,Ka2=7.0×10-15,向NaCN溶液中通入少量的H2S气体,反应的化学方程式为_________________________。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含Mn2+为0.0020 mol·L-1的废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4 mol·L―1时,Mn2+开始沉淀,则a=__________。[已知:Ksp(MnS)=1.4×10-15]
查看答案和解析>>
科目: 来源: 题型:
【题目】“垃圾是放错了位置的资源”,应该分类回收。生活中废弃的铁锅、铝质易拉罐、钢导线等可以归为一类加以回收,它们属于( )
A.有机物
B.金属或合金
C.氧化物
D.盐
查看答案和解析>>
科目: 来源: 题型:
【题目】
A.蒸发使用的主要仪器是蒸发皿、酒精灯、玻璃棒、带铁圈的铁架台
B.分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
C.丁达尔效应可以鉴别胶体和溶液
D.用规格为10 mL的量筒量取6.20 mL的液体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于晶体的叙述中错误的是( )
A. 金刚石中由共价键形成的最小的碳原子环上有六个碳原子
B. NaCl晶胞中共有4个Na+和4个Cl﹣
C. 在CsCl晶体中每个Cs+周围紧邻的有8个Cl﹣,而和每个Cs+等距离紧邻的也有8个Cs+
D. 在面心立方最密堆积的金属晶体中,每个金属原子周围紧邻的有12个金属原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com