
科目: 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)I的最高化合价为__________,K的元素名称为__________。
(2)写出基态时Q元素原子的电子排布式__________,J元素原子的外围电子排布式________________。
(3)下列对比正确的是__________。
a.原子半径H>G>B>A
b.第一电离能E>D>C>B
c.电负性A>H>G>Q
d.最高价氧化物的水化物酸性B>A>H>G
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是__________。
a.L位于元素周期表第五周期ⅠA族,属于s区元素
b.O位于元素周期表第七周期Ⅷ族,属于ds区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
【答案】 +6 铜 1s22s22p63s23p63d104s24p1 3d64s2 cd bc
【解析】试题分析:(1)I是Cr元素,价电子排布是3d54s1;K是29号元素Cu;(2)Q是31号元素Ga;(3)电子层数越多半径越大,电子层数相同时,质子数越多半径越小;同周期元素从左到右第一电离能增大,N元素2p能级为半充满状态,第一电离能大于相邻的O元素;同周期元素从左到右电负性增强,同主族元素从上到下电负性减小;非金属性越强,最高价氧化物的水化物酸性越强;(4)L是Rb元素,位于元素周期表第五周期ⅠA族,价电子排布是5S1;Ⅷ族的元素,属于d区元素;M的外围电子排布式为5d106s1;H所在族的位ⅣA族,外围电子排布式为ns2np2,属于p区元素;
解析:(1)I是Cr元素,价电子排布是3d54s1,所以最高化合价为+6;K是29号元素Cu,名称是铜;(2)Q是31号元素Ga,核外电子排布式是1s22s22p63s23p63d104s24p1;(3)电子层数越多半径越大,电子层数相同时,质子数越多半径越小,原子半径G>H>A>B,故a错误;同周期元素从左到右第一电离能增大,N元素2p能级为半充满状态,第一电离能大于相邻的O元素,所以第一电离能Ne>F>N>O,故b错误;同周期元素从左到右电负性增强,同主族元素从上到下电负性减小,所以电负性A>H>G>Q,故c正确;非金属性越强,最高价氧化物的水化物酸性越强,最高价氧化物的水化物酸性HNO3>H2CO3>H2SiO3>Al(OH)3,故d正确;(4)L是Rb元素,位于元素周期表第五周期ⅠA族,价电子排布是5S1,属于s区元素,故a正确;Ⅷ族的元素,属于d区元素,O位于元素周期表第七周期Ⅷ族,属于d区元素,故b错误;M的外围电子排布式为5d106s1,故c错误;H所在族的位ⅣA族,外围电子排布式为ns2np2,属于p区元素,故d正确。
点睛:同周期元素从左到右第一电离能增大,ⅤA族元素p能级为半充满状态,能量低,第一电离能大于相邻的ⅥA族元素,如第二周期的N元素第一电离能大于O。
【题型】综合题
【结束】
23
【题目】已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B、C均可分别与A形成10个电子分子,B、C属同一周期,两者可以形成许多种共价化合物,C、F属同一主族,B原子最外电子层的p能级上的电子处于半满状态,C的最外层电子数是内层电子数的3倍,E最外层电子数比最内层多1。请用具体的元素回答下列问题:
(1)E元素原子基态电子排布式 。
(2)用电子排布图表示F元素原子的价电子构型 。
(3)F、G元素对应的最高价含氧酸中酸性较强的分子式为 。
(4)离子半径D+ B3—,第一电离能B C,电负性C F
(填“<”、“>”或“=”)。
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比1∶1,X的电子式为 ,试写出Cu、稀H2SO4与X反应制备硫酸铜的离子方程式 。
(6)写出E与D的最高价氧化物对应的水化物反应的化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
【题目】钼(Mo)是一种重要的过渡金属元素,钼酸钠(Na2MoO4)是一种无公害型冷却水系统的金属缓蚀剂。以钼精矿(主要成分为MoS2)为原料制备金属钼和钼酸钠晶体的主要流程如图所示。
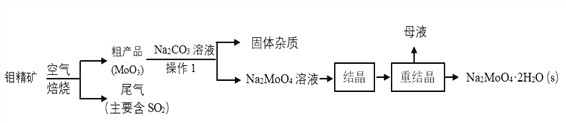
(1)Na2MoO4·2H2O 中钼元素的化合价为____________;
(2)在焙烧反应中,每生成1mol MoO3时转移电子数为:_______ (以NA表示阿伏加德罗常数的值);
(3)操作1中,粗产品中的MoO3与Na2CO3溶液充分反应后,生成Na2MoO4和另外一种物质,该物质的电子式为_____;
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因______________________________________;
(5)结晶操作前需加入Ba(OH)2固体以除去溶液中的SO42-,SO42-的最大去除率是_____(结果保留一位小数)[已知:碱浸液中c(MoO42-)=0.80mol·L-1,(SO42-)=0.04mol·L-1,Ksp(BaSO4)=1.0×10-10,Ksp(BaMoO4)=4.0×10-8,Ba(OH)2引起的溶液体积变化忽略。]
(6)下图是碳钢在3 种不同介质中的腐蚀速率实验结果:
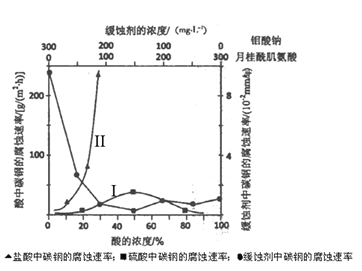
①试分析I、II曲线变化趋势不同的原因________________________________________
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3 保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是_________________________________________________。
③要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号。其中J为0族元素。
X | Y | Z | |
R | |||
W | |||
J |
请回答下列问题(除特别说明外,凡涉及用元素回答的问题均用具体元素符号表示):
(1)R原子的电子排布图为__________。
(2)在化合物YZ2中Y的化合价为__________;Y2-与Na+的半径大小为__________。
(3)在X、Y、Z三种元素中,电负性由大到小的顺序是__________;X与Y的第一电离能:X__________Y(填“<”、“>”或“=”),其理由是__________________________________________________________。
【答案】 ![]() +2 O2->Na+ F>O>N > N原子的p轨道为半充满,能量低较稳定,难失电子
+2 O2->Na+ F>O>N > N原子的p轨道为半充满,能量低较稳定,难失电子
【解析】试题分析:X、Y、Z、R、W、J是前五周期的元素,其中J为0族元素,所以X、Y、Z、R、W、J分别是N、O、F、S、Br、Xe;
解析:(1)R是S元素,原子的电子排布图为![]() 。
。
(2)化合物YZ2是OF2,F元素的化合价是-1,所以O元素的化合价为+2;O2-与Na+都有2个电子层,钠的质子数大于氧,所以半径大小为O2->Na+ 。
(3)同周期元素从左到右电负性增大,所以在N、O、F三种元素中,电负性由大到小的顺序是F>O>N;N原子2p能级半充满,能量低较稳定,第一电离能大于相邻的氧元素,N与O的第一电离能:N>O。
【题型】综合题
【结束】
22
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)I的最高化合价为__________,K的元素名称为__________。
(2)写出基态时Q元素原子的电子排布式__________,J元素原子的外围电子排布式________________。
(3)下列对比正确的是__________。
a.原子半径H>G>B>A
b.第一电离能E>D>C>B
c.电负性A>H>G>Q
d.最高价氧化物的水化物酸性B>A>H>G
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是__________。
a.L位于元素周期表第五周期ⅠA族,属于s区元素
b.O位于元素周期表第七周期Ⅷ族,属于ds区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示甲是某学生验证铜和浓硝酸反应的装置,乙、丙是另外两位同学对甲装置改进后的装置:
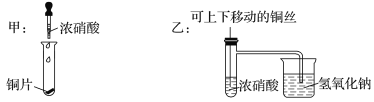
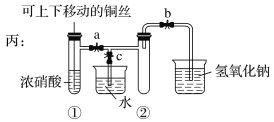
(1)甲、乙、丙三个装置中共同发生的反应的化学方程式是__________________________________。
(2)和甲装置相比,乙装置的优点是①______________________;②________________。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。实验时先关闭活塞________,再打开活塞________,才能使NO2气体充满②试管;当气体充满②试管后,将铜丝提起与溶液脱离。欲使烧杯中的水进入②试管,应该_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
X | L层p电子数比s电子数多2个 |
Y | 第三周期元素的简单离子中半径最小 |
Z | L层有三个未成对电子 |
(1)写出元素X的离子结构示意图__________。
(2)写出Y元素最高价氧化物的水化物分别与HCl、NaOH溶液反应的离子方程式_______________________、_________________________。
(3)写出Z与Y的电子排布式______________、________________。
(4)元素T与氯元素相比,非金属性较强的是__________(用元素符号表示),下列表述中能证明这一事实的是__________。
A.气态氢化物的挥发性和稳定性
B.单质分子中的键能
C.两元素的电负性
D.含氧酸的酸性
E.氢化物中X—H键的键长(X代表T和Cl两种元素)
F.两单质在自然界中的存在形式
(5)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是__________(填元素符号),理由是________________________________________________。
【答案】 ![]() Al(OH)3+3H+===Al3++3H2O Al(OH)3+OH-===AlO
Al(OH)3+3H+===Al3++3H2O Al(OH)3+OH-===AlO![]() +2H2O 1s22s22p3 1s22s22p63s23p1 F CE Al 具有金属性
+2H2O 1s22s22p3 1s22s22p63s23p1 F CE Al 具有金属性
【解析】试题分析:T单质能与水剧烈反应,所得溶液呈弱酸性,所以T是F元素;X元素的L层p电子数比s电子数多2个,X元素是O元素;Y元素是第三周期元素的简单离子中半径最小,Y是Al元素;Z元素L层有三个未成对电子,Z是N元素;
解析:根据以上分析,(1)X为O元素,氧离子核外最外层达到8电子稳定结构,氧离子结构示意图![]() 。
。
(2)Y元素最高价氧化物水化物Al(OH)3,为两性氢氧化物,与盐酸反应生成氯化铝和水,离子方程式为Al(OH)3+3H+===Al3++3H2O;与氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式为Al(OH)3+OH-===AlO![]() +2H2O;
+2H2O;
(3)Z是N元素,电子排布式是1s22s22p3; Y是Al元素,电子排布式是1s22s22p63s23p1。
(4)T是F元素,同主族元素从上到下,非金属性减弱,与氯元素相比,非金属性较强的是F;
A.气态氢化物的挥发性不能证明非金属性的强弱,故A错误;
B.单质分子中的键能,不能证明非金属性的强弱,故B错误;
C.非金属性越强,电负性越大,根据两元素的电负性可以判断非金属性,故C正确;
D.根据最高价含氧酸的酸性可以判断非金属性,故D错误;
E.键长越长,越不稳定,
F.单质在自然界中的存在形式,不能判断非金属性,故F错误。
(5)Al为金属元素,具有金属性,其它三种元素为非金属元素,具有较强的非金属性。
点睛:元素非金属性强弱的判断方法:①越易与氢气化合,非金属性越强;②气态氢化物越稳定,非金属性越强;③单质的氧化性越强,非金属性越强;④最高价含氧酸的酸性越强,非金属性越强。
【题型】综合题
【结束】
21
【题目】下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号。其中J为0族元素。
X | Y | Z | |
R | |||
W | |||
J |
请回答下列问题(除特别说明外,凡涉及用元素回答的问题均用具体元素符号表示):
(1)R原子的电子排布图为__________。
(2)在化合物YZ2中Y的化合价为__________;Y2-与Na+的半径大小为__________。
(3)在X、Y、Z三种元素中,电负性由大到小的顺序是__________;X与Y的第一电离能:X__________Y(填“<”、“>”或“=”),其理由是__________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有部分前36号元素的性质或原子结构如下表
元素编号 | 元素性质或原子结构 |
R | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
S | 单质能与水剧烈反应,所得溶液呈弱酸性 |
T | 基态原子3d轨道上有1个电子 |
X | |
(1)R元素的第一电离能要大于其同周期相邻的元素,原因是________________________________________________________。
(2)S元素的化合价是否有正价?__________,原因是__________________________________,最外层电子排布式为________________________。
(3)T元素的原子N能层上电子数为__________,其原子结构示意图为__________。
(4)X的核外电子排布图违背了__________。用X单质、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:____________________________________________________________________。
【答案】 氮原子2p轨道半充满,能量低,稳定 否 F的电负性最大,只能得电子 2s22p5 2  能量最低原理 电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量
能量最低原理 电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量
【解析】试题分析:R元素的基态原子最外层有3个未成对电子,次外层有2个电子,R是N元素;S元素的单质能与水剧烈反应,所得溶液呈弱酸性,S是F元素;T元素的基态原子3d轨道上有1个电子,T是21号元素Sc; X元素的原子核外有12个电子,X是Mg元素。
解析:根据以上分析,(1)R是N元素,氮原子2p轨道半充满,能量低,稳定,所以第一电离能要大于其同周期相邻的O元素。
(2)元素F的电负性最大,只能得电子,所以F元素没有正价;F元素的最外层电子排布式为2s22p5。
(3)Sc原子的核外电子排布式是1s22s22p63s23p63d14s2,所以N能层上电子数为2,其原子结构示意图为 。(4)根据能量最低原理,Mg原子最外层2个电子应排布在3s轨道上,所以核外电子排布图违背了能量最低原理。电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量,所以燃放焰火时,焰火发出五颜六色的光。
。(4)根据能量最低原理,Mg原子最外层2个电子应排布在3s轨道上,所以核外电子排布图违背了能量最低原理。电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量,所以燃放焰火时,焰火发出五颜六色的光。
【题型】综合题
【结束】
20
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
X | L层p电子数比s电子数多2个 |
Y | 第三周期元素的简单离子中半径最小 |
Z | L层有三个未成对电子 |
(1)写出元素X的离子结构示意图__________。
(2)写出Y元素最高价氧化物的水化物分别与HCl、NaOH溶液反应的离子方程式_______________________、_________________________。
(3)写出Z与Y的电子排布式______________、________________。
(4)元素T与氯元素相比,非金属性较强的是__________(用元素符号表示),下列表述中能证明这一事实的是__________。
A.气态氢化物的挥发性和稳定性
B.单质分子中的键能
C.两元素的电负性
D.含氧酸的酸性
E.氢化物中X—H键的键长(X代表T和Cl两种元素)
F.两单质在自然界中的存在形式
(5)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是__________(填元素符号),理由是________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】完成下列填空
(1)决定物质体积的因素:①构成物质的粒子数;②粒子大小;③粒子间的距离。对固体、液体物质而言,它主要是由上述________(填写编号,下同)决定;对气体物质而言,它主要由上述____________决定。
(2)标准状况下,体积为11.2 L的CO2的质量________g,其所含原子的总数是________个。
(3)现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
①该气体的物质的量为________mol。
②该气体在标准状况下的体积为________ L。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚砷酸(H3AsO3)可用于治疗白血病,在溶液中存在多种微粒形态。向1L0.1mol·L-1 H3AsO3溶液中逐滴加入0.1mol·L-1KOH溶液,各种微粒物质的量分数与溶液的pH关系如下图所示。下列说法正确的是( )

A. H3AsO3的电离常数Ka1的数量级为10-9
B. pH在8.0~10.0时,反应的离子方程式:H3AsO3+OH-=H2AsO3-+H2O
C. M点对应的溶液中:c(H2AsO3-)+c(HAsO32-)+c(AsO33-)+c(H3AsO3)=0.1mol·L-1
D. pH=12时,溶液中:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+)
查看答案和解析>>
科目: 来源: 题型:
【题目】在如图装置中,烧瓶中充满干燥气体a。将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满整个烧瓶。a和b可能是

a(干燥气体) | b(液体) | |
① | NH3 | 水 |
② | CO2 | 饱和NaOH溶液 |
③ | Cl2 | 饱和食盐水 |
④ | NO2 | 水 |
⑤ | HCl | 0.1 mol·L1AgNO3溶液 |
A. ①②③ B. ①②⑤ C. ②④⑤ D. ①②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com