
科目: 来源: 题型:
【题目】在水中,水分子可彼此通过氢键形成(H2O)n的小集团。在一定温度下(H2O)n的n=5,每个水分子被4个水分子包围着形成四面体。(H2O)n的n=5时,下列说法中正确的是 ( )
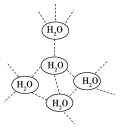
A.(H2O)n是一种新的水分子
B.(H2O)n仍保留着水的化学性质
C.1 mol(H2O)n中有2个氢键
D.1 mol(H2O)n中有4 mol氢键
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中只含有Na+、Al3+、Cl﹣、SO42﹣ 四种离子,已知前三种离子的个数比为3:2:1,则溶液中Al3+和 SO42﹣的离子个数比为( )
A.1:2
B.1:4
C.3:4
D.3:2
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氧化锌及氧化锌都是重要的含锌化合物。氢氧化锌是难溶于水的白色固体,在水中的电离形式与Al(OH)3相似。常温下,水溶液中不同形式含锌微粒物质的量浓度(对数值lgc)与pH的关系如下图所示。回答下列问题:

(1)向ZnCl2溶液中滴加NaOH溶液至过量,看到的现象是___________________________;实验室中若用Zn、NaOH溶液和稀盐酸制备Zn(OH)2,最佳方案是______________________。
(2)根据图中数据可知,常温下,Ksp[Zn(OH)2]=_________。
(3)工业上可用菱锌矿(主要成分是ZnCO3,还含有少量的Fe2O3、FeO、CuO等杂质)为原料制取氧化锌。工艺流程如下:

①氧化锌是__________(填“酸性”或“碱性”或“两性”)氧化物。上述流程中,“试剂甲”参与反应的离子方程式为______________________________________。
②可以利用碳酸锌代替氨水来调节溶液的pH并得到氢氧化铁沉淀,原因是________;若“乙溶液”中c(Fe3+)为2.6×10-18mol/L,则c(Zn2+)为______mol/L(已知:Ksp[Fe(OH)3]=2.6×10-39)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫化钠又称硫化碱,为无色、易溶于水和热乙醇的固体,常用于制造硫代硫酸钠、多硫化钠、硫化染料等。实验室中用工业硫化钠(因含重金属硫化物和煤粉等而呈褐色)、纯碱等物质制备硫代硫酸钠晶体(Na2S2O3·5H2O)的原理如下:Na2CO3+SO2=Na2SO3+CO2 S+ Na2SO3![]() Na2S2O3。回答下列问题:
Na2S2O3。回答下列问题:
(1)工业硫化钠的纯化
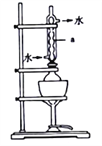
将18g工业硫化钠加入烧瓶中,再加入150mL95%的乙醇溶液和8mL水。用如图所示装置进行沸水浴加热,并回流40min,趁热过滤,冷却、搅拌、结晶、倾析,除去上层母液;最后用95%的乙醇溶液洗涤,烘干,得到Na2S·9H2O晶体。图中仪器a的名称是_______,该过程中回流40min的目的是_______________________________。
(2)硫代硫酸钠的制备
称取纯化后的Na2S·9H2O晶体14.4g和mgNa2CO3,混合后置于锥形瓶中,加入150mL蒸馏水,微热后按图所示组装仪器;然后,打开分液漏斗的活塞和螺旋夹6,并适当调节该螺旋夹,向锥形瓶中通入SO2气体,当溶液呈中性时,停止通入SO2气体,对反应后落液进行后续处理,即可制得硫代硫酸钠(Na2S2O3·5H2O)。
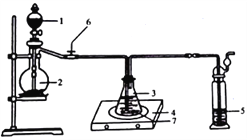
①适当调节螺旋夹6的目的是_______________________________________;
②实验过程中,通入SO2一段时间后,溶液中会生成大量淡黄色沉淀,然后又变澄清。生成淡黄色沉淀的化学方程式为____________________________________。若通入SO2气体时间过长,会降低硫代硫酸钠的产率,原因是_______________________。
③为提高产品纯度,节约原料,m=____g;
④反应结束后,需对溶液进行后续处理,得到硫代硫酸钠晶体(Na2S2O3·5H2O),其操作是蒸发浓缩,冷却结晶、过滤、_____、烘干。称量所得产品,质量为ng,则Na2S2O3·5H2O的产率为_____________%。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)实验室制取氯气时,下列操作不正确的是________(填字母)。


A.装置Ⅰ可用于制取少量氯气
B.用装置Ⅱ除去氯气中的少量氯化氢
C.用装置Ⅲ制取氯气
D.用装置Ⅳ干燥氯气
(2)实验室制取干燥、纯净的氯气,除了二氧化锰、浓盐酸外还需要的试剂是____________、____________、____________。
(3)已知高锰酸钾与浓盐酸在常温下反应能产生氯气。
若用如下图所示的实验装置来制备纯净、干燥的氯气及验证它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是________(填字母)。
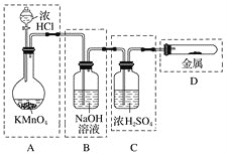
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中,能大量共存的离子组是
A.K+、Na+、CO32-、NO3-B.Ag+、Na+、SO42-、Cl-
C.OH-、HCO3-、Ca2+、Na+D.Ba2+、Na+、OH-、SO42—
查看答案和解析>>
科目: 来源: 题型:
【题目】钇钡铜氧(YBa2Cu3O7-x)类高温超导材料(其中Y显+3价,Cu显+2、+3价)可由Y2(CO3)3、BaCO3和CuCO3混合在高温下反应制得。回答下列问题:
(1)Y(钇)是一种稀土金属元素,与Sc(钪)同族相邻。X在元素周期表中的位置是_______,目前的周期表中,该族共有______种元素。
(2)基态Cu3+的电子排布式为________。铜有CuO和Cu2O两种氧化物,后者比前者热稳定性强,原因是____________________________________。
(3) CO32-中C原子釆取_______杂化;第一电离能:C_____O(填“>”或“<”)。
(4)某种钇钡铜氧材料中x=0.2,则n(Cu3+):n(Cu2+)=________。
(5)如图是另一种钇钡铜氧超导材料的晶胞结构示意图,其化学式为______,晶体中Y3+的坐标是______;若其摩尓质量为Mg·mol-1,阿伏加徳罗常数的值为NA,则该晶体的密度为____g·cm-3。

查看答案和解析>>
科目: 来源: 题型:
【题目】等质量的甲、乙、丙三种金属,分别与足量的溶质质量分数相同的稀硫酸完全反应后,都生成+2价的硫酸盐,其产生氢气的体积与反应时间的关系如图所示,则下列说法正确的是
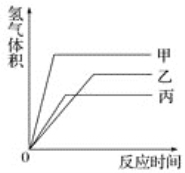
A. 三种金属的活动性顺序为甲>乙>丙
B. 反应结束消耗硫酸的质量一定相同
C. 三种金属的相对原子质量是甲>乙>丙
D. 甲先反应完,乙最后反应完
查看答案和解析>>
科目: 来源: 题型:
【题目】无机化合物可根据其组成和性质进行分类。

(1)上图所示的物质分类方法名称是________。
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表中。
___________、______________、_______________
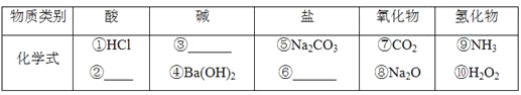
(3)写出⑦转化为⑤的化学方程式:__________________________________________。
(4)实验室制备⑦常用________和________反应,检验该气体的方法是_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com