
科目: 来源: 题型:
【题目】如图所示是过氧化氢(H2O2)分子的空间结构示意图。
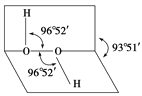
(1)写出过氧化氢分子的电子式________。
(2)下列关于过氧化氢的说法中正确的是(填序号)____。
①分子中有极性键 ②分子中有非极性键 ③氧原子的轨道发生了sp2杂化 ④O—O共价键是p—pσ键 ⑤分子是非极性分子
(3)过氧化氢分子之间易形成氢键,该氢键的表示式是____________。
(4)过氧化氢难溶于二硫化碳,主要原因是______________________;过氧化氢易溶于水,主要原因是________________________。
(5)过氧乙酸也是一种过氧化物,它可以看作是过氧化氢分子中的一个氢原子被乙酰基(CH3CO)取代的产物,是一种常用的杀菌消毒剂。在酸性条件下过氧乙酸易发生水解反应生成过氧化氢。
①写出过氧乙酸发生水解反应的化学方程式(有机物用结构简式表示):____________。
②过氧乙酸用作杀菌消毒剂的原因是________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Ka(CH3COOH)=1.7×10-5,Kb(NH3·H2O)=1.7×10-5。25℃时,向40ml浓度均为0.01mol·L-1的盐酸和醋酸(1:1)混合溶液中逐滴加入0.10mol·L-1的氨水,测定过程中电导率和pH变化曲线如图所示,下列说法正确的是

A. a点溶液中,c(CH3COO-)数量级约为10-5
B. b点溶液中,c(NH4+) < c(CH3COOH)
C. c点溶液中,c(NH4+) > c(Cl-)+c(CH3COO-)
D. d点水的电离程度大于c点
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,这些元素组成的单质和化合物转化关系如下图所示。其中C是淡黄色固体,B和E的水溶液均具有漂白性。下列说法不正确的是

A. 简单离子半径:Y>Z>X B. 沸点:D
C. 气态氢化物稳定性:Z>Y D. 0.1mol·L-1A溶液中:c(H+)>c(HY-)>c(Y2-)
查看答案和解析>>
科目: 来源: 题型:
【题目】手持技术的氧电化学传感器可用于测定O2含量,下图为某种氧电化学传感器的原理示意图。已知在测定O2含量过程中,电解质溶液的质量保持不变。一定时间内,若通过传感器的待测气体为aL(标准状况),某电极增重了bg。下列说法正确的是

A. Pt上发生氧化反应
B. Pb上发生的电极反应式为Pb-2e-+2OH-=Pb(OH)2
C. 反应过程中转移OH-的物质的量为0.25bmol
D. 待测气体中氧气的体积分数为0.7b/a
查看答案和解析>>
科目: 来源: 题型:
【题目】铝是地壳中含量最高的金属元素,其单质及合金在生产生活中应用日趋广泛。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3杂质,SiO2在“碱溶”时转化为铝硅酸钠沉淀)为原料制备铝的一种工艺流程如下:
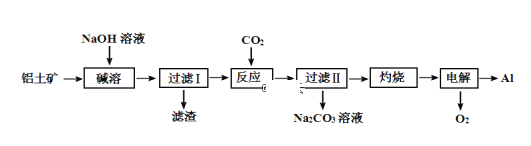
(1)“过滤Ⅰ”时滤渣的主要成分为 ______________ 、______________。
(2)“碱溶”时生成偏铝酸钠的离子方程式为____________________________。
(3)“反应”时,也可以用NaHCO3代替CO2,写出加入NaHCO3溶液后的离子方程式________________。
(4)“电解”时加入冰晶石的作用是___________________________________。
(5)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气存在下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是_________________。
②1mol镁铝合金(Mg17Al12)分别与足量的盐酸、氢氧化钠溶液充分反应,生成的氢气在相同条件下的体积比为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示:
含氧酸酸性强弱与非羟基氧原子数的关系
次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
含氧酸 | Cl—OH |
|
|
|
非羟基氧原子数 | 0 | 1 | 2 | 3 |
酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
(1)亚磷酸H3PO3和亚砷酸H3AsO3分子式相似,但它们的酸性强弱相差很大,H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性。由此可知它们的结构式分别为①__________,②__________。
(2)H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是①__________,②__________。
(3)在H3PO3和H3AsO3中分别加入浓盐酸,分析反应情况__________,写出反应的化学方程式________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表所列是A、B、C、D、E五种短周期元素的相关数据:
A | B | C | D | E | |
化合价 | -4 | -2 | -1 | -2 | -1 |
电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 |
(1)元素A是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是________。
A.![]() B.CH4
B.CH4
C.CH2==CHCH3 D.CH3CH2C≡CH E.CH3CH3
(2)用氢键表示式写出E的氢化物的水溶液中存在的所有氢键:____________。
(3)相同条件下,AD2与BD2分子在水中的溶解度较大的是______(化学式),理由是____。
(4)B、D形成的氢化物沸点:________更高,热稳定性________更强。(写化学式)
查看答案和解析>>
科目: 来源: 题型:
【题目】若ABn分子的中心原子上没有孤对电子,应用价层电子对互斥模型理论,判断下列说法正确的是
A. n=3时,则分子的立体构型为V形
B. n=2时,则分子的立体构型平面三角形
C. n=4时,则分子的立体构型为正四面体形
D. n=4时,则分子的立体构型为三角锥形
查看答案和解析>>
科目: 来源: 题型:
【题目】正硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子之间通过氢键相连(层状结构如图所示,图中“虚线”表示氢键)。下列有关正硼酸的说法正确的是 ( )
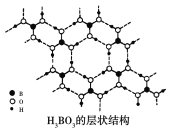
A.1 mol H3BO3晶体中含有6 mol氢键
B.硼原子、氧原子最外层均为8电子的稳定结构
C.H3BO3分子中既存在σ键,又存在π键
D.H3BO3分子的稳定性与氢键无关
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.硫酸、纯碱、硝酸钠和生石灰分别属于酸、碱、盐和氧化物
B.根据元素种类的多少将物质分为纯净物和混合物
C.通常情况下,若发生反应A2 + 2B-= 2A-+ B2,则氧化剂是A2
D.碳酸氢钠在水中的电离方程式:NaHCO3=Na++H++CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com