
科目: 来源: 题型:
【题目】原子序数依次增大的四种元素X、Y、Z、W分别处于第一至第四周期,自然界中存在多种X的化合物,Y原子核外电子有6种不同的运动状态,Y与Z可形成正四面体形分子,W的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为_________。
(2)Z所在主族的四种元素分别与X形成的化合物,沸点由高到低的顺序是______(填化学式),呈现如此递变规律的原因是________________________________。
(3)Y元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为___,另一种的晶胞如图二所示,该晶胞的空间利用率为________________(保留两位有效数字)。(![]() )
)
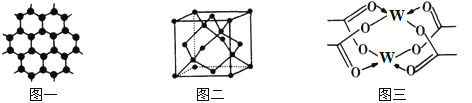
(4)W元素形成的单质,其晶体的堆积模型为___________,W的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是____________(填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向W的硫酸盐溶液中滴加过量氨水,观察到的现象是____________。请写出上述过程的离子方程式___________________________ ,___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验结果与图像不相符的是

A. 向含有盐酸、氯化镁和氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量
B. 向澄清石灰水中通入二氧化碳气体直至过量
C. 向氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量
D. 向氯化铝的溶液中逐渐加入氨水直至过量
查看答案和解析>>
科目: 来源: 题型:
【题目】符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变△H=△H1+△H2。满足上述条件的X、Y可能是

①C、CO ②S、SO2 ③Na、Na2O ④AlCl3、Al(OH)3 ⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
A. ①④⑤ B. ①②③ C. ①③④ D. ①③④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常通过高温分解FeSO4的方法制备Fe2O3,其化学方程式为:2FeSO4![]() Fe2O3+SO2↑+SO3↑为检验FeSO4高温分解的产物,进行如下实验
Fe2O3+SO2↑+SO3↑为检验FeSO4高温分解的产物,进行如下实验
(1)检验产物Fe2O3取少量FeSO4高温分解得到的固体,加入一定量__________溶解,再向该溶液中加入适量的__________溶液,如有____________现象产生,则证明产物中存在Fe2O3
(2)检验气体产物:将FeSO4高温分解产生的气体通入下图三个装置中,以检验产生的气体中是否含有SO2、SO3。
①三个装量的连接序为_______________(填装置序号)
②实验中如观察到装置A中品红溶液______,装置B BaCl2溶液中__________,则可证明FeSO4高温分解产生的气体中含有SO2、SO3。
③装置C中NaOH溶液的作用是_______________(用离子方程式表示〕。

查看答案和解析>>
科目: 来源: 题型:
【题目】对于常温下pH=1的硝酸溶液,有关叙述:
①该溶液1mL稀释至100mL后,pH=3
②向该溶液中加入等体积、pH=13的氢氧化钡溶液恰好完全中和
③该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为1×10﹣12
④向该溶液中加入等体积、等浓度的氨水,所得溶液pH=7
其中正确的是
A. ①② B. ①③ C. ②④ D. ③④
查看答案和解析>>
科目: 来源: 题型:
【题目】元素原子的核外电子排布决定了元素在元素周期表中的位置,已知某元素原子的核外电子排布式为1s22s22p63s23p63d34s2。该元素位于元素周期表
A. 第4周期第ⅤB族 B. 第4周期第ⅡA族
C. 第2周期第ⅡB族 D. 第5周期第ⅡB族
查看答案和解析>>
科目: 来源: 题型:
【题目】某物质灼烧焰色反应为黄色,下列判断正确的是( )
A.该物质一定是钠的化合物B.该物质一定含钠离子
C.该物质一定是金属钠D.不能确定该物质是否含钾元素
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2)是一种优良的消毒剂,熔点为-59℃,沸点为 11℃,浓度过高时易发生分解,甚至爆炸。某课外兴趣小组通过氯气与 NaClO2溶液反应来制取少量ClO2,装置如下图所示:
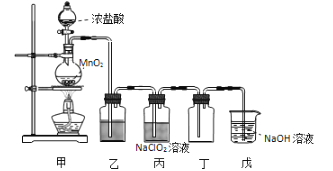
(1)甲装置中圆底烧瓶内发生反应的化学方程式是____________________。
(2)丙装置中发生的反应可能经两步完成,请将其补充完整:
①____________________________________________(用化学方程式表示),
②HClO + HCl + 2NaClO2 2ClO2↑+ 2NaCl + H2O。
(3)Clˉ存在时会催化 ClO2的生成,若无乙装置,则丙装置内产生 ClO2的速率明显加快。乙装置中试剂瓶内的液体是__________。实验过程中常需通入适量的 N2稀释 ClO2,其目的是_______________________。
(4)戊装置烧杯中 NaOH 溶液吸收 ClO2后,生成了 ClO2-、ClO3-,该反应的离子方程式是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com