
科目: 来源: 题型:
【题目】如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化的须色变化。实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选。完成下列问题:
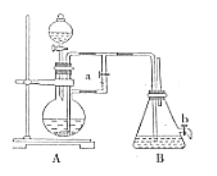
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是_______________,A中发生反应的目的是_____________________________。
(2)实验开始时应先将弹簧夹a________(填“打开”或“关闭”)。
(3)装置B中生成Fe(OH)2的操作及观察到的现象为_______________。
(4)实验完毕,打开b处弹簧夹,放入一部分空气,此时B中发生的反应为_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Al、Mg及其化合物在生产、生活中有着广泛的应用,请按要求回答下列问题。
I. 用废铝渣制备Al(OH)3的流程如下图所示,假设反应①杂质不反应。
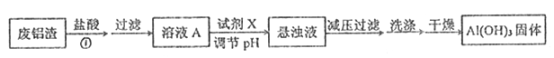
(1)Al在元素周期表中的位置为______,试剂X的名称______ 。
(2)溶液A显酸性的原因可能是(可用离子方程式表示) a.盐酸过量;b. ____________。
II.用镁硅酸盐矿石制备高纯度Mg(OH)2的流程如下图所示:
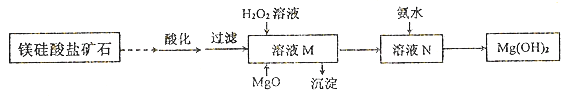
已知:①溶液M中除含Mg2+、SO42-外,还含少量Fe3+、 Al3+、Fe2+等离子;
②Mg2+与氨水的反应为吸热反应。
(1)向溶液M中先加入的试剂是_______;产生的沉淀有_____。H2O2参与反应的离子方程式是____________________。
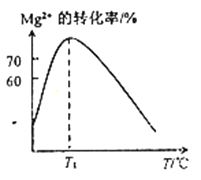
(2)溶液N中Mg2+的装化率随温度T的变化情况如图所示。T1之后,Mg,2+的转化率减小的原因是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关金属及其化合物的说法正确的是( )
A.钠保存在煤油里的原因之一是它极易与氧气反应
B.焰色反应是化学变化,可以用玻璃棒做焰色反应实验
C.CaO、Na2O、Na2O2均为碱性氧化物
D.可用澄清石灰水来鉴别NaHCO3和Na2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】在无色强酸性溶液中,下列各组离子能够大量共存的是
A. Al3+、Fe2+、Cl-、SO42-B. NH4+、HCO3-、Cl-、K+
C. Na+、Ba2+、NO3-、SO42-D. Cl -、Na+、NO3-、Ca2+
查看答案和解析>>
科目: 来源: 题型:
【题目】将a克Fe2O3、Al2O3样品溶解在过量的400mL 0.1molL﹣1的硫酸溶液中,然后向其中加入NaOH 溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH 溶液100mL,则NaOH 溶液的浓度为( )
A. 0.1 molL﹣1 B. 0.2 molL﹣1 C. 0.4 molL﹣1 D. 0.8 molL﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)请写出H2SO3的电离平衡常数K1的表达式:________________。
(2) 常温下,将体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
(3)一定条件下,冰醋酸加水稀释过程中溶液导电能力I随加水体积V变化曲线如右图所示,则a、b、c三点溶液醋酸的电离程度由大到小为____________________。

(4)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为___________。
(5)体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(6)已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是
A. 金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
B. 钠与水的反应:Na+2H2O=Na++2OH-+H2↑
C. 铜片跟稀硝酸的反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O
D. 将氯气通入氯化亚铁溶液:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
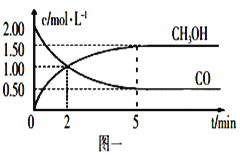
①从反应开始到5min,用CO表示的平均反应速率v(CO)=________。
②下列说法正确的是____________(填字母序号)。
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △H= - 178.3kJ/mol
①计算反应ⅣC(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=_______kJ/mol;
CaCO3(s)+2H2(g)的△H=_______kJ/mol;
若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,则反应Ⅳ平衡常数K=__________(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s) ![]() CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
A.降低体系的温度 B.压缩容器的体积 C.增加CaO的量 D.选用适当的催化剂
(3)对于可逆反应C(s)+2H2O(g)+CaO(s) ![]() CaCO3(s)+2H2(g),该反应_______(填“能”或“不能”)自发进行。
CaCO3(s)+2H2(g),该反应_______(填“能”或“不能”)自发进行。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是
A. 空气、硫酸铜、硫酸B. 醋酸、液氯、纯碱
C. 硝酸、食盐水、烧碱D. 氧化铁、胆矾、熟石灰
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于分散系的说法中正确的是( )
A.不能发生丁达尔效应的分散系有氯化钠溶液、水等
B.可吸入颗粒(例如硅酸盐粉尘)形成气溶胶,对人类健康的危害更大
C.胶体的分散质粒子的直径为1~10 nm
D.氯化铁溶液与氢氧化铁胶体的本质区别是有无丁达尔效应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com