
科目: 来源: 题型:
【题目】Ⅰ. 分类法对研究化学物质和化学反应有重要的意义,请完成下列问题。今有七种物质: ①铝线 ②熔化的KNO3 ③氯气 ④NaCl晶体 ⑤液态氯化氢 ⑥石灰水 ⑦乙醇,其中能导电的物质是_______,属于电解质的是____,属于非电解质的是__。写出⑥与足量碳酸氢钠溶液反应的离子方程式:_____。
Ⅱ.实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 _____________________________。
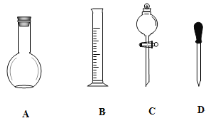
(2)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取NaOH固体的质量为_______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1mol/L(填“大于”“小于”或“等于”)。
(4)若用18.4mol/L的浓硫酸进行配制,所需该浓硫酸的体积为____________mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)147 g H2SO4的物质的量是________;0.5 mol H2SO4的质量是________g;
(2)氧化铜在高温下发生分解反应:4CuO![]() 2Cu2O+O2↑,若反应过程中生成1molO2分子,则转移电子数为____________mol。
2Cu2O+O2↑,若反应过程中生成1molO2分子,则转移电子数为____________mol。
(3)反应:2FeCl3+2KI=2FeCl2+2KCl+I2,其中_____元素化合价升高,则该元素被_______,_____元素化合价降低;__________做还原剂,_______发生还原反应。
(4)钠在空气中燃烧的化学方程式:________________________________,1mol钠完全燃烧转移电子的个数为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】近几年,具有超常性能的铝离子电池成为研究热点,其可在一分钟内完成充放电。铝与石墨为电极,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示。下列说法错误的是
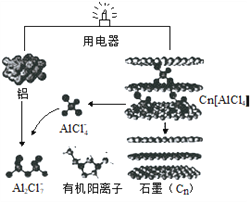
A. 放电时,有机阳离子向石墨电极方向移动
B. 放电时,正极的电极反应式为:Cn[AlCl4]+e-=Cn+AlCl4-
C. 充电时,每生成1mol铝,同时消耗4molAl2Cl7-
D. 充电时铝电极接电源负极,该极有Cn[AlCl4]生成
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是
①电解池是将化学能转变为电能的装置
②原电池是将电能转变成化学能的装置
③不能自发进行的氧化还原反应,通过电解的原理有可能实现
④电镀过程相当于金属的“迁移”,可视为物理变化
A. ③B. ③④C. ②③④D. ①②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于天然物质水解的叙述正确的是
A. 油脂的水解反应都是皂化反应B. 蛋白质水解的最终产物均为葡萄糖
C. 油脂的水解可得到甘油D. 淀粉水解和纤维素水解得到的最终产物不同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 常温常压下,22.4 L CO2中含有NA个CO2分子
B. 标况下22.4 L空气含有NA个单质分子
C. 22.4 L Cl2中含有NA个Cl2分子
D. 标况下1.12L O2和1.12L CO2均含有0.1NA个氧原子
查看答案和解析>>
科目: 来源: 题型:
【题目】下列结构图中,●代表前二周期元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表价键。示例:(图中F2)根据各图表示的结构特点,下列有关叙述正确的是( )

A. 上述结构图中共出现6种元素 B. 甲、乙、丙为非极性分子,丁为极性分子
C. 甲与丁可以发生化合反应生成离子化合物 D. 向CaCl2溶液中通入丙有白色沉淀产生
查看答案和解析>>
科目: 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,易被氧气氧化。利用如图装置,在锥形瓶中加入HCOONa、NaOH、CH3OH和水形成的混合液,通入SO2时发生反应生成保险粉和一种常见气体,下列说法错误的是
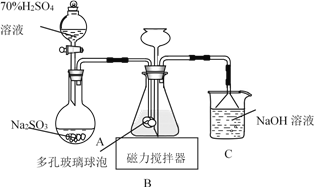
A. 制备保险粉的离子方程式为HCOO-+OH-+2SO2===S2O42-+CO2↑+H2O
B. NaOH溶液的主要作用是吸收逸出的CO2
C. 多孔玻璃球泡的作用是增大气体与溶液的接触面积,使SO2能被充分吸收
D. 为避免产生的Na2S2O4被O2氧化,使硫酸与亚硫酸钠先反应,产生的SO2排出装置中残留的O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com