
科目: 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
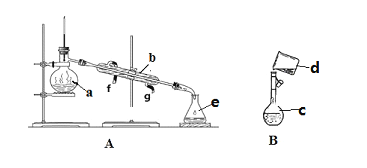
(1)写出下列仪器的名称:a.____________,b.___________,c.__________。
(2)若利用装置分离酒精和水的混合物,还缺少的仪器是______,冷凝水由___口流出(填f或g)。
(3)现需配制0.1mol/LNaOH溶液450mL,装置B是某同学转移溶液的示意图。
①图中的错误是_____________________________。
②根据计算得知,所需NaOH的质量为____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究证明高铁酸钠(Na2FeO4) 是一种“绿色环保高效”消毒剂, 比目前国内外广泛使用的含氯饮用水消毒剂性能更为优良。高铁酸钠只能在碱性环境中稳定存在。下列是通过次氯酸钠氧化法制备高铁酸钠并探究其性质的实验,步骤如下:
I.用氯气和氢氧化钠溶液反应制备NaClO溶液
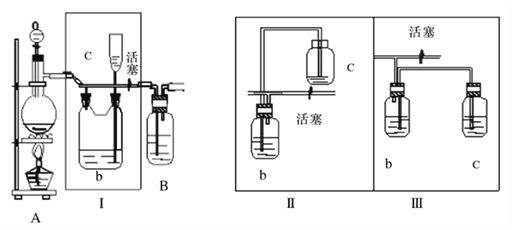
(1)A是氯气发生装置,写出实验室用此装置制取氯气的离子方程式__________。
(2)I装置的作用是__________ 。
(3)用图示的II或III代替I是否可行? __________。简要说明理由__________ 。
(4)将产生的氯气通入D装置中制NaClO溶液
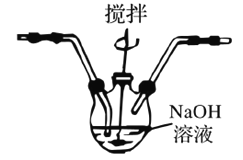
已知:3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O 为了防止产生NaClO3,除搅拌和混入N2稀释外,还应采取的操作是__________。
5NaCl+NaClO3+3H2O 为了防止产生NaClO3,除搅拌和混入N2稀释外,还应采取的操作是__________。
II.制备Na2FeO4
(1)将Fe(NO3)3溶液加入到NaOH与NaClO的混合溶液中,其反应的离子方程式是______。过滤得到粗产品,再用NaOH溶液溶解,重结晶,用有机溶剂脱碱,低温烘干得到固体样品,上述制备过程中,用NaOH溶液溶解粗产品而不用水的原因是__________。
(2)高铁酸钠电池是一种新型可充电电池,电解质为NaOH溶液,放电时负极材料为Zn,正极产生红褐色沉淀,写出该电池反应的化学方程式__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】晶体具有规则的几何外形,晶体中最基本的重复单位称为晶胞。NaCl晶体结构如图所示。已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1,测知FexO晶体密度ρ=5.71 g·cm-3,晶胞边长为4.28×10-10m。
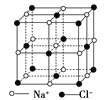
(1)FexO中x值(精确至0.01)为________。
(2)晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中,Fe2+所占分数(用小数表示,精确至0.001)为________。
(3)此晶体的化学式为________。
(4)与某个Fe2+(或Fe3+)距离最近且等距离的O2-围成的空间几何形状是________。
(5)在晶体中,铁离子间最短距离为________cm。
查看答案和解析>>
科目: 来源: 题型:
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100mol/L盐酸分别滴定10.00mL浓度均为0.100mol/L的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温下Kb=1.6×10-4)。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法错误的是
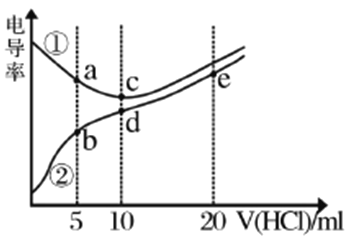
A. a、d、e三点的溶液中,水的电离程度最大的是d点
B. 溶液温度c点高于d点
C. b点溶液中:c[(CH3)2NH2+]+c[(CH3)2NH·H2O]=2c(Cl-)
D. d点溶液中:c(H+)+ c[(CH3)2NH·H2O]=c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:
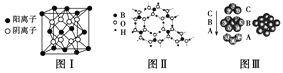
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为________。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________,H3BO3晶体中硼原子个数与极性键个数比为________。
(3)金属铜具有很好的延展性、导电传热性,对此现象最简单的解释是用________理论。
(4)三种晶体中熔点最低的是________,其晶体受热熔化时,克服的微粒之间的相互作用为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】锌是一种重要的过渡金属,锌及其化合物有着广泛的应用。
(1)指出锌在周期表中的位置:第________周期,第________族,________区。
(2)Zn形成金属晶体,其金属原子堆积属于下列______模式。
A.简单立方 B.钾型 C.镁型 D.铜型
(3)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式________;葡萄糖分子中碳原子的杂化方式为________。
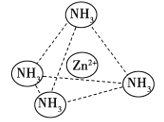
(4)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子属于________(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,NH3位于正四面体的顶点,试在右下图中表示[Zn(NH3)4]2+中Zn2+与NH3之间的化学键______。
(5)下图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为______________________。该化合物晶体的熔点比干冰高得多,原因是____________________。

(6)与锌同周期,最外层有3个未成对电子的元素名称是________,该元素最高价氧化物对应水化物的酸性比溴的最高价氧化物对应水化物的酸性________(填“强”或“弱”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】锂离子电池已经成为应用最广泛的可充电电池,某种锂离子电池的结构示意图如下,它在放电时有关离子转化关系如图所示,下列说法正确的是

A. Li+透过膜除允许Li+通过外,还允许H2O分子通过
B. 充电时,电池内部发生的总反应为Li++Fe2+![]() Li+Fe3+
Li+Fe3+
C. 充电时,钛电极与外电源的负极相连
D. 放电时,进入贮罐的液体发生的离子反应方程式为:S2O82-+Fe2+=Fe3++2SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】用“双桥法”表示下列氧化还原反应中电子转移的方向和数目,并指出氧化剂和还原剂。2KClO3 === 2KCl+3O2↑ _______氧化剂_____ 还原剂_____
查看答案和解析>>
科目: 来源: 题型:
【题目】观察下列模型并结合有关信息,判断下列说法不正确的是( )
HCN | S8 | SF6 | B12结构单元 | |
结构模型 示意图 |
|
|
|
|
备注 | — | 易溶于CS2 | — | 熔点1 873 K |
A. HCN的结构式为H—C≡N,分子中含有2个σ键和2个π键
B. 固态硫S8属于原子晶体
C. SF6是由极性键构成的非极性分子
D. 单质硼属原子晶体,结构单元中含有30个B—B键
查看答案和解析>>
科目: 来源: 题型:
【题目】下列装置或操作能达到实验目的的是
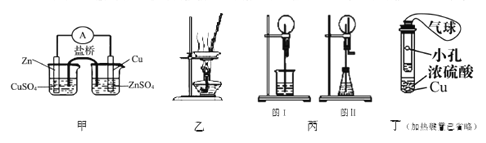
A. 甲装置构成铜锌原电池
B. 用图乙所示装量加热AlCl3饱和溶液然后利用余热蒸干制备AlCl3固体
C. 丙装置里图I烧瓶中充满氨气,烧杯中盛装水,在图II的锥形瓶中,加入足量的Cu与稀硝酸,图I和图II都产生喷泉现象且原理相同
D. 利用丁装置制取SO2,并检验其还原性,小试管中的试剂可为酸性KMnO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com