
科目: 来源: 题型:
【题目】对于常温下pH=1的硝酸溶液,有关叙述:
①该溶液1mL稀释至100mL后,pH=3
②向该溶液中加入等体积、pH=13的氢氧化钡溶液恰好完全中和
③该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为1×10﹣12
④向该溶液中加入等体积、等浓度的氨水,所得溶液pH=7
其中正确的是
A. ①② B. ①③ C. ②④ D. ③④
查看答案和解析>>
科目: 来源: 题型:
【题目】用如图所示装置探究铁粉在高温下与水蒸气反应的实验。

(1)A装置加热作用是___________________________;
(2)B中反应的化学方程式:_________________________________________,标准状况下,若该反应生成22.4L气体,则反应转移的电子数为______________。
(3)装置D中的现象是___________________,写出D中反应方程式:_________________。
(4)A 、B两处酒精灯点燃顺序:____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1mol乙醇分子中含有极性键的数目为8NA
B. 80℃时,1LpH=1的硫酸溶液中,含H+的数目为0.2NA
C. Na2O2与2.24LCO2完全反应,转移电子的数目为0.1NA
D. 1molH2和1molI2于密闭容器中充分反应后,其分子总数目为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)R单质的晶体在不同温度下有两种原子堆积方式,晶胞分别如下图所示。A中原子堆积方式为________堆积,A、B中R原子的配位数之比为________。
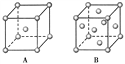
(2)已知单质D为面心立方晶体,如图所示,D的相对原子质量为M,密度为8.9 g/cm3。
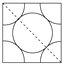
试求:
①图中正方形边长=________cm(只列出计算式,NA表示阿伏加德罗常数的值)。
②试计算单质D晶体中原子的空间利用率:________(列出计算式并化简)。
查看答案和解析>>
科目: 来源: 题型:
【题目】2017年11月16日新闻报道“阿斯利康哮喘”新药获批上市,哮喘率降低近51%,有机物Z可用于治疗哮喘、系统性红斑狼疮等。其合成路线如下图所示
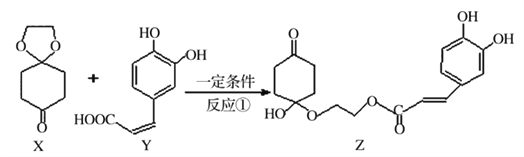
(1)化合物X的有_______种化学环境不同的氢原子。
(2)下列说法正确的是_______.
A.X是芳香化合物 B.Ni催化下Y能与5molH2加成
C.Z能发生加成、取代及消去反应 D. lmolZ最多可与5molNaOH反应
(3)Y与过量的溴水反应的化学方程式为_________。
(4)X可以由_______(写名称)和M(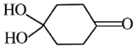 ) 分子间脱水而得;一定条件下,M发生1个—OH的消去反应得到稳定化合物N (分子式为C6H8O2),则N的结构简式为_____(己知烯醇式不稳定,会发生分子重排,例如:
) 分子间脱水而得;一定条件下,M发生1个—OH的消去反应得到稳定化合物N (分子式为C6H8O2),则N的结构简式为_____(己知烯醇式不稳定,会发生分子重排,例如: 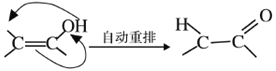 )。
)。
(5)Y也可以与环氟丙烷 )发生类似反应①的反应,其生成物的结构简式为_________(写一种);Y的同分异构体很多种,其中有苯环、苯环上有二个取代基(且酚羟基的位置和数目都不变)、属于酯的同分异构体有_____种。
)发生类似反应①的反应,其生成物的结构简式为_________(写一种);Y的同分异构体很多种,其中有苯环、苯环上有二个取代基(且酚羟基的位置和数目都不变)、属于酯的同分异构体有_____种。
(6) 可由
可由 和有机物H分子间脱去一分子水而得,则H的名称为________;通常采用
和有机物H分子间脱去一分子水而得,则H的名称为________;通常采用![]() 为原料合成
为原料合成 ,请参照题目路线图设计该合成路线(无机试剂任选) _______。(合成路线常用的表示方式为:
,请参照题目路线图设计该合成路线(无机试剂任选) _______。(合成路线常用的表示方式为:  )
)
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D四种常见的金属单质,A的焰色为黄色;B为红色固体,锈蚀时变为绿色;C在空气中加热熔化但不滴落;D在氧气中燃烧,火星四射,生成黑色固体。
根据以上信息回答下列问题:
(1)写出对应化学式:A________,B________,C________,D________。
(2)写出下列化学方程式:
①A在空气中燃烧_______________________________________;
②B与AgNO3 溶液:_________________________________;
③C与氢氧化钠溶液:___________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子的2p能级有3个电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。回答下列问题:
(1)写出基态E+的价电子排布式:_________。基态A原子的第一电离能比B的大,其原因是__________。
(2)A5+由美国空军研究实验室推进科学与先进概念部Karl .O. Christed 于1999年成功合成,其结构呈‘V'形且该离子中各原子均达到8电子稳定结构,则A5+的结构式为________。
(3)B3分子的空间构型为______,其中B原子的杂化类型是______,与B3分子互为等电子体的微粒有_________(写一种离子)。
(4)向E的硫酸盐溶液中通入A的气态氢化物至过量,产生蓝色沉淀,随后沉淀溶解得到深蓝色溶液,向溶液中加入适量乙醇,析出蓝色晶体。加入乙醇的目的___________。 写出该配合物中配离子的结构简式__________。
(5)由长周期元素组成的镧镍合金、铜钙合金有相同类型的晶体结构XYn,它们有很强的储氢能力,其中铜钙合金的晶体的部分结构如图所示。

己知镧镍合金(LaNin)晶体中的重复结构单元如图一所示,该结构单元的体积为9.0×10-23cm3,储氢后形成LaNinH4.5的合金(氢进入晶体空隙,体积不变),则LaNin中n=___ (填数值);氢在合金中的密度为_______g/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙二醛是一种低级醛,它有着极其活跃的化学反应性,并有广泛的用途。
I.乙二醛的工业制法如下:
(1)乙醛(CH3CHO)液相硝酸氧化法
在Cu(NO3)催化下,用稀硝酸氧化乙醛制取乙二醛,反应的离子方程式为___________。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点是____________ 。
(2)乙二醇(HOCH2CH2OH)气相氧化法
①已知:OHC-CHO(g)+2H2(g)![]() HOCH2CH2OH(g) △H=-78kJ/mol K1
HOCH2CH2OH(g) △H=-78kJ/mol K1
2H2(g)+O2(g)![]() 2H2O(g) △H=-484kJ/mol K2
2H2O(g) △H=-484kJ/mol K2
乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g)![]() OHC-CHO(g)+2H2O(g)的相同温度下,该反应的化学平衡常数K=___(用含K1、K2的代数式表示)。
OHC-CHO(g)+2H2O(g)的相同温度下,该反应的化学平衡常数K=___(用含K1、K2的代数式表示)。
②当原料气中氧醇比为1.35时,乙二醛和副产物CO2的产率与反应温度的关系如图所示。反应温度在450~495℃之间和超过495℃时,乙二醛产率降低的主要原因分别是____、____。
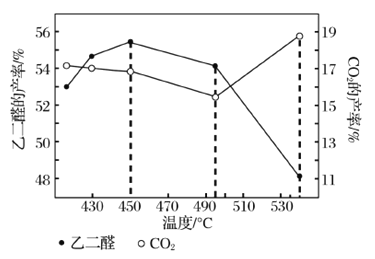
II.乙二醛的用途之一是可以电解氧化制备乙醛酸(OHC-COOH),其生产装置如图所示,通电后,阳极产生的Cl2与乙二醛溶液反应生成乙醛酸。
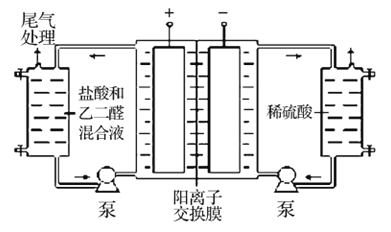
(3)阴极反应式为_________。
(4)阳极液中盐酸的作用,除了产生氯气外,还有__________作用。
(5)保持电流强度为aA,电解tmin,制得乙醛酸mg,列式表示该装置在本次电解中的电流效率η=__________ (已知:法拉第常数为fC·mol-l;![]() )
)
查看答案和解析>>
科目: 来源: 题型:
【题目】钒(23V)是我国的丰产元素,广泛用于催化及钢铁工业。回答下列问题:
(1)钒在元素周期表中的位置为_______,其价层电子排布图为____________。
(2)钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为____、_____。
(3)V2O5常用作SO2转化为SO3的催化剂。SO2分子中S原子价层电子对数是__对,分子的立体构型为___;SO3气态为单分子,该分子中S原子的杂化轨道类型为____;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为___;该结构中S—O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为__(填图2中字母),该分子中含有___个σ键。
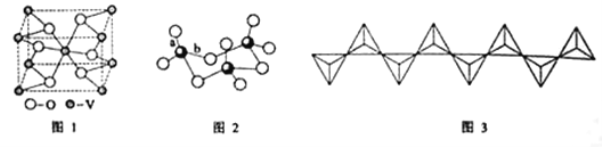
(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为___;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜及其化合物在生产生活中有广泛应用
(1)工业上以黄铜矿(CuFeS2)为原料,采用火法熔炼工艺生产铜的中间过程会发生反应:2Cu2O+Cu2S![]() 6Cu+SO2↑该反应的氧化剂是________,验证反应产生的气体是SO2的方法是___________。
6Cu+SO2↑该反应的氧化剂是________,验证反应产生的气体是SO2的方法是___________。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,温度控制在50℃~60℃的两个原因除了加快反应速率外,还有___________。在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,生成CuC1沉淀,写出生成CuCl的离子方程式______________。
(3)碱式碳酸铜在有机催化剂、烟火制造和颜料、农药生产中有广泛的应用。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备碱式碳酸铜的流程如下:

①辉铜矿在浸取前要富集与粉碎,粉碎的好处是___________。
②浸取过程中得到一种单质,写出浸取时主要反应的化学方程式___________。
③写出“沉锰”反应时离子方程式___________。
④“除铁”这一步反应在25℃进行,加入氨水调节溶液pH为4后,溶液中铜离子最大浓度不超过_________mol/L。(已知Ksp[Cu(OH)2]=2.2×10-20)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com