
科目: 来源: 题型:
【题目】某公司设计的用于驱动潜艇的液氨-液氧燃料电池示意图如下,有关说法正确的是
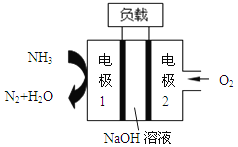
A. 电池总反应为:4NH3+3O2=2N2+6H2O
B. 电池工作时,OH-向正极移动
C. 电极 2 发生的电极反应为:O2+4H++4e-=2H2O
D. 电流由电极 1 经外电路流向电极2
查看答案和解析>>
科目: 来源: 题型:
【题目】实验题
Ⅰ.海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI=2KCl+I2。请 回答下列问题:
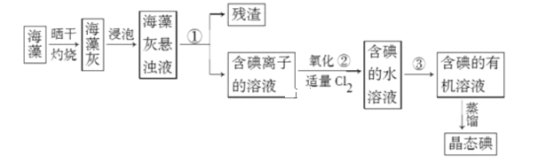
(1)指出提取碘的过程中有关实验操作①和③的名称:________;________。
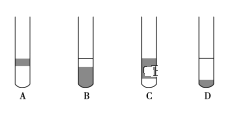
(2)在 3 mL 碘水中,加入 1 mL 四氯化碳,振荡、静置后,观察到试管里的分层现象是下图中的________ (注:试管中深色区为紫红色溶液)。
Ⅱ.欲配制 480mL0.5mol·L-1 的 NaOH 溶液,试回答下列问题。
(3)配制上述溶液需要的仪器有:药匙、托盘天平、量筒、玻璃棒、________。
(4)应称取的 NaOH 固体的质量为________ g。
(5)某学生实际配制的 NaOH 溶液的浓度为 0.51mol·L-1,原因可能是_________。
A.使用滤纸称量 NaOH 固体 B.容量瓶中原来存有少量水
C.溶解后的烧杯未经多次洗涤 D.用胶头滴管加水定容时俯视刻度
E.加水时超过刻度线,用胶头滴管吸出 F.转移溶液之前未经冷却
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的HX、HY溶液,pH随NaOH溶液体积变化如图。下列结论正确的是
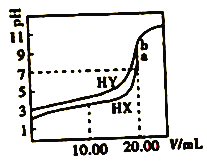
A. 水解常数:X->Y-
B. a、b两点溶液混合后:c(HX)+c(HY)+c(H+)=c(OH-)
C. pH=7时,c(Y-)>c(X-)
D. 10.00mlL时,有c(Na+)>c(HX)>c(X-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温时,用0.1000mol/LNaOH滴定25.00 mL 0.1000 mol/L某一元酸HX,滴定过程中pH变化曲线如图所示。下列说法正确的是 ( )

A. 滴定前,酸中c(H+)等于碱中c(OH-)
B. 在A点,c(Na+)>c(X-)>c(HX)>c(H+)>c(OH-)
C. 在B点,两者恰好完全反应
D. 在C点,c(X-)+c(HX)=0.05mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )
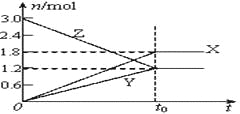
A. 该反应的化学方程式为:3X+2Y![]() 2Z
2Z
B. 若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间小于t0
C. 若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
D. 若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子在指定溶液中可以大量共存的是
A. pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
B. 加入Al放出H2的溶液中:SO42-、NH4+、Na+、F-
C. pH=7的溶液中:SO32-、Na+、K+、ClO—
D. 无色溶液中:K+、SO42-、Cu2+、Cl—
查看答案和解析>>
科目: 来源: 题型:
【题目】镁-空气电池的工作原理如图所示,电池反应方程式为:2Mg+O2+2H2O=2Mg(OH)2。下列说法错误的是
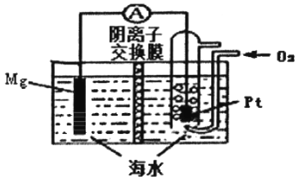
A. 通入氧气的电极为正极
B. 放电时,溶液中的OH-由正极移向负极
C. 负极的电极反应为Mg-2e-=Mg2+
D. 采用多孔Pt电极有利于氧气扩散,提高电极与电解质溶液的接触而积
查看答案和解析>>
科目: 来源: 题型:
【题目】利用下图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓氯水 | NaBr | 淀粉KI溶液 | 氧化性:Cl2>Br2>I2 | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | Br2的苯溶液 | 铁屑 | AgNO3溶液 | 苯与溴单质在铁催化剂作用下 发生取代反应 | |
D | 硝酸 | Na2SO3 | KMnO4溶液 | SO2能使KMnO4溶液褪色 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】完成下列填空:
(1)要使 NH3 与 CH4 含相同数目的 H 原子,则 NH3 和 CH4 的物质的量之比为_______。
(2)19g 某二价金属氯化物(ACl2)中含有 0.4mol Cl, ACl2 的化学式是_____。
(3)在标准状况下,V L H2 中含有 N 个氢分子,则阿伏加德罗常数为_____mol-1。
(4)实验室某盐酸试剂的密度为 1.19g/mL,质量分数为 36.5%,则该盐酸的物质的量浓度为_____mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验。

(1)往A溶液中分别滴入几滴KSCN溶液,溶液的颜色__________,
(2)根据上述过程写出有关反应的离子方程式:Fe3O4→A _________________,A→B ___________。
(3)向B溶液中加入NaOH溶液,可看到的现象是_______________________________________,此过程中发生的氧化还原反应化学方程式为__________________________________。
(4)将A的饱和溶液滴入沸水中并不断加热,可制得_______________胶体;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为___________效应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com