
科目: 来源: 题型:
【题目】取一定物质的量浓度的NaOH溶液100mL,然后向其通入一定量的CO2气体,得到溶液A,向A中逐滴缓慢加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况)与所加HCl溶液的体积之间关系如图所示,通过计算回答:
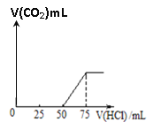
(1)A溶液中的溶质为_________(化学式),其物质的量之比是_______。
(2)通入CO2气体体积__________________(标准状况)。
(3)NaOH溶液的物质的量浓度______________________。
(4)假如通入的CO2气体为112mL, 画出得到溶液逐滴缓慢加入0.1mol/L的HCl溶液体积,与产生的CO2气体体积(标准状况)的关系图________________。(应体现关键点的数据)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:![]() 、
、![]()
I.冠心平F是降血脂、降胆固醇的药物,它的一条合成路线如下:
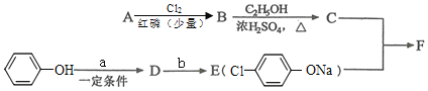
(1)A为一元羧酸,8.8gA与足量NaHCO3溶液反应生成2.24LCO2(标准状况),A的分子式为____________。
(2)写出符合A分子式的所有甲酸酯的结构简式:________________。
(3)B是氯代羧酸,其核磁共振氢谱有两个峰,写出B→C的反应方程式:____________。
(4)C+E→F的反应类型为____________。
(5)写出A和F的结构简式:____________。
(6)D的苯环上有两种氢,它所含官能团的名称为_____________;写出b所代表的试剂为____________。
II.有机物H的分子式为C2H2O3,可发生银镜反应,且具有酸性。
(7)H有多种合成方法,在方框中写出由乙酸合成H的路线流程图(其他原料任选)。合成路线流程图示例如下:![]() ________________________________________________。
________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】是应用最广泛的金属,铁的氯化物、氧化物均为重要化合物。
(1)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
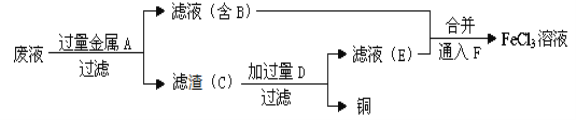
①滤渣C的化学式为_____________。
②通入F发生反应的化学方程式为_________________________。
③要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为________。
a.加入足量氯水b.加入足量KMnO4溶液 c.加入少量KSCN溶液
A.ac B.cb C.ca D.abc
(2)四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具.水热法制备Fe3O4纳米颗粒的反应是:
3Fe2++2S2O32-+O2+xOH- ═Fe3O4↓+S4O62-+2H2O.请回答下列问题.
①水热法制备Fe3O4纳米颗粒的反应中,还原剂是__________.
②反应的化学方程式中x=______.
③每生成1molFe3O4,反应转移的电子为____________mol,被Fe2+还原的O2的物质的量为______mol.
查看答案和解析>>
科目: 来源: 题型:
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示:
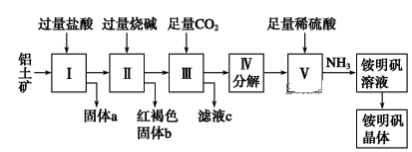
请回答下列问题:
(1)固体a的化学式为________。
(2)写出Ⅱ中加过量的烧碱涉及到的反应离子方程式______________、_____________;Ⅲ中通入足量CO2气体发生反应的离子方程式为_______________。
(3)由Ⅲ中得到滤液c的实验操作为__________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)________、冷却结晶、过滤洗涤。
(4)将NH4Al(SO4)2溶液和Ba(OH)2溶液,按物质的量比1:2混合,写出离子方程式为_______________。
(5)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ、为测定金属钠样品(表面有 Na2O)中钠单质的质量分数,设计了如下实验(反应装置如图所示):

①称量 A、B 的总质量
②称取一定质量的钠样品
③将钠样品投入锥形瓶中,迅速塞紧带 U 形干燥管(内含无水 CaCl2 干燥 剂)的橡皮塞 。有关数据是:称取的金属钠样品质量为 a g,A、B 反应前总质量为 b g,反应后 A、B 的总质量为 c g。 请根据题意回答下列问题:
(1)A 中钠和水反应过程可看到钠熔成闪亮的小球,产生这一现象原因是:_____________
(2)用 a、b、c 表示的钠单质的质量分数为_______________
(3)如果没有 B 装置对实验结果有何影响___________。(填“偏大”或“偏小”“不影响”)
Ⅱ、现用金属钠和空气制备纯度较高的 Na2O2,可利用的装置如下图。回答下列问题:


(4)上述装置Ⅳ中盛放的试剂是______,为完成实验应将装置Ⅳ接在_____(填写字母号)。
A.I 之前 B. I 和 II 之间 C. II 和 III 之间 D.III 之后
(5)点燃酒精灯后,观察到装置 II 中的现象为_____。
Ⅲ、现用制得纯度较高的 Na2O2进行相关实验。回答下列问题:
(6)用脱脂棉包住Na2O2粉末,置于石棉网上,通过细管向脱脂棉中吹CO2,脱脂棉_______(填“能”或“不能”)燃烧起来。
(7)盛有0.78 g Na2O2、1.68g NaHCO3的固体混合物放在密闭容器中加热,最后固体质量为_________g.
查看答案和解析>>
科目: 来源: 题型:
【题目】C、N、O、Na、Mg、Al、S、Cl是常见的八种元素,根据元素及其化合物性质,回答下列问题:
(1)S在周期表中的位置为______;CO2的电子式是_______。
(2)比较O、Na元素常见离子的半径大小(用化学式表示,下同)____>____;__________比较S、Cl元素的最高价氧化物对应水化物的酸性强弱:____>____ 。_______________
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是___________;制铝时,电解Al2O3而不电解AlCl3的原因是___________ 。
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的结构简式为______;Q的化学式为_______ 。
(5)熔融状态下,钠和FeCl2能组成可充电电池(装置示意图如下),反应原理为:2Na+FeCl2![]() Fe+2NaCl.放电时,电池的正极反应式为___________;充电时,_______(写物质名称)电极接电源的负极;该电池的电解质为_______。
Fe+2NaCl.放电时,电池的正极反应式为___________;充电时,_______(写物质名称)电极接电源的负极;该电池的电解质为_______。
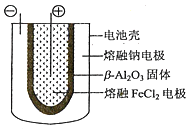
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)称取一定质量的纯碱溶于水中,与适量的盐酸作用,下列关于盐酸的用量和气体产量的变化是(填偏大、偏小、不变)
①若纯碱中混有K2CO3,盐酸用量将____________;气体产量将_______________。
②若纯碱中混有NaHCO3,盐酸用量将___________;气体产量将_______________。
(2)写出下列离子方程式
①金属钠投入CuSO4溶液_____________________ 。②向饱和食盐水中通入足量氨气和二氧化碳:___________.
(3)向1L,1mol/L的氯化铝溶液中加入含氢氧化钠xmol的氢氧化钠溶液,当铝元素以Al(OH)3和AlO2-形式存在时x的取值范围是_______,当x=3.6时,Al(OH)3的质量为________.
查看答案和解析>>
科目: 来源: 题型:
【题目】1994年度诺贝尔化学奖授予为研究臭氧做出贡献的化学家。臭氧能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图:呈V形,两个O—O键的夹角为116.5°。三个原子以一个O原子为中心,与另外两个O原子分别构成非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键(虚线内部)——三个O原子均等地享有这4个电子。请回答:
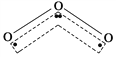
(1)题中非极性共价键是________键,特殊的化学键是________键。
(2)臭氧与氧气的关系是____________________。
(3)下列分子中与O3分子的结构最相似的是(____)
A.H2O B.CO2 C.SO2 D.BeCl2
(4)分子中某原子有一对或几对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有______对孤对电子。
(5)O3具有强氧化性,它能把PbS氧化为PbSO4而O2不能,试配平:___PbS+___O3===___PbSO4+____O2,生成1 mol O2,转移电子的物质的量为______mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
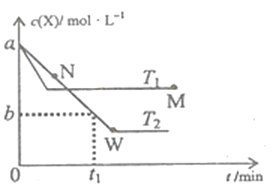
A. M点的正反应速率υ正小于N点的逆反应速率υ逆
B. T2下,在0~t1时间内,υ(Y)=![]() mol/(L·min)
mol/(L·min)
C. M点时再加入一定量X,平衡后X的转化率减小
D. 该反应进行到M点放出的热量小于进行到W点放出的热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com