
科目: 来源: 题型:
【题目】密闭容器中有1mol NaHCO3和0.8mol Na2O2,加热充分反应后,容器内残留的固体
A. 0.5molNa2CO3和0.8mol Na2O2 B. 0.5molNa2CO3和1.6molNaOH
C. 0.8molNa2CO3和1molNaOH D. 1molNa2CO3和0.6molNaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙两烧杯各盛有100 mL 3 mol·L-1的盐酸和氢氧化钠溶液,向烧杯分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲∶乙=3∶4,则加入铝粉的质量为
A. 1.8 g B. 2.7 g C. 3.6 g D. 5.4 g
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化钠与水反应后滴加酚酞,酚酞先变红后褪色。某小组欲探究其原因,进行以下实验:①取反应后溶液加入二氧化锰后迅速产生大量气体;实验②、③中红色均不褪去。下列分析错误的是
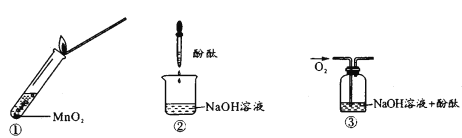
A. 过氧化钠与水反应产生的气体为O2
B. 过氧化钠与水反应需要MnO2作催化剂
C. 实验②、③证明使酚酞褪色的不是氢氧化钠和氧气
D. 过氧化钠与水反应可能生成了具有漂白性的H2O2
查看答案和解析>>
科目: 来源: 题型:
【题目】利用木质纤维可合成药物中间体E,还能合成高分子化合物H,合成路线如下:
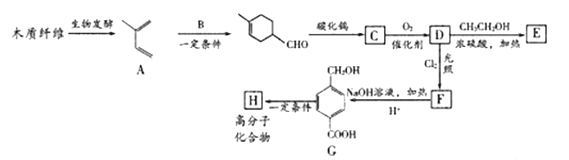
已知:
①
②![]()
回答下列问题:
(1)C的化学名称是__________,F所含官能团的名称是__________。
(2)G![]() H的反应类型是________。
H的反应类型是________。
(3)B的结构简式是____________
(4)F与NaOH溶液反应的化学方程式是___________
(5)符合下列条件的E的同分异构体共有_____种。
①分子中苯环上有两个对位取代基
②能发生银镜反应
③能和钠反应放出氢气,不与FeCl3溶液发生显色反应
(6)根据题给信息,写出以2-丁烯,HOOCCH=CHCOOH为原料,制备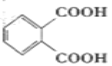 的合成路线:________________(其它试剂任选)。
的合成路线:________________(其它试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为周期表中部分元素的某种性质(X值)随原子序数变化的关系。
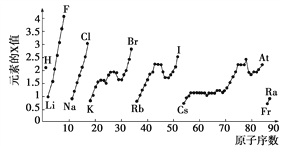
(1)短周期中原子核外p轨道上电子数与s轨道上电子总数相等的元素是________(写元素符号)。
(2)同主族内不同元素的X值变化的特点是 ________________,同周期内,随着原子序数的增大,X值变化的总趋势是________。周期表中X值的这种变化特点体现了元素性质的____________变化规律。
(3)X值较小的元素集中在元素周期表的________。
a.左下角 b.右上角 c.分界线附近
(4)下列关于元素该性质的说法中正确的是________(选填代号)。
a.X值可反映元素最高正化合价的变化规律
b.X值可反映原子在分子中吸引电子的能力
c.X值大小可用来衡量元素金属性和非金属性的强弱
查看答案和解析>>
科目: 来源: 题型:
【题目】钛及其化合物的应用越来越受到人们的关注。
(1)基态Ti原子核外电子排布的最高能级符号是________。与钛同周期元素中,基态原子的未成对电子数与钛相同的有_______种。
(2)钛比钢轻,比铝硬,是种新兴的结构材料。钛硬度比铝大的原因是_________
(3)催化剂M能催化乙烯、丙烯、米乙烯等的聚合,其结构如图所示。
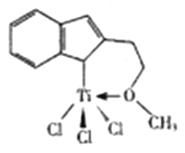
①M中,碳原子的杂化形式有__________种。
②M中,不含___________(填标号)。
a.π键 b.σ键 c.配位键 d.氢键 e.离子健
(4)金红石(TiO2)是含钛的主要矿物之一,具有典型的四方晶系结构。其晶胞结构(晶胞中相同位置的原子相同)如图所示。

①4个微粒A、B、C、D中,属于氧原子的是______
②若A、B、C的原子坐标分别为A(0,0,0)、(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,___________,_____________);钛氧键键长d=_________(用代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的最低能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
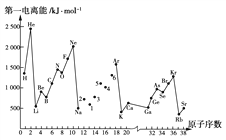
请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,将Na~Ar之间的元素用短线连接起来,构成完整的图象________。
(2)从上图分析可知,同一主族元素原子的第一电离能I1的变化规律是_________。
(3)上图中5号元素在周期表中的位置是_________________________________。
(4)上图中4、5、6号三种元素的气态氢化物的化学式分别为__________________。
(5)上图中1~6号元素中,最高价氧化物对应水化物中酸性最强的是_______,两性化合物有______。
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。
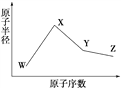
(1)X位于元素周期表中第________周期第________族;W的基态原子核外有_____个未成对电子。
(2)Z的气态氢化物和溴化氢相比,较稳定的是______(写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氯的制备、应用等环节。回答下列问题:
(1)氢气的制备
以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示。
反应Ⅱ包含两步反应:
①H2SO4(1)=SO3(g)+H2O(g) ΔH=177kJ/mol
②2SO3(g)=2SO2(g)+O2(g) △H=196kJ/mol
写出反应Ⅱ的热化学反应方程式__________
(2)氯气的应用
CO2加氢制备甲酸(HCOOH)可用于回收利用CO2。温度为T1时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g)![]() HCOOH(g) △H,化学平衡常数K=1
HCOOH(g) △H,化学平衡常数K=1
实验测得:v正=k正·c(CO2)·c(H2), v逆=k逆·c(HCOOH),k正、k逆为速率常数。
①当CO2的转化率为33.3%时,HCOOH的体积分数为_____(保留整数)。
②T1时,k逆=_________(用k正表示)。当升高温度至T2时,k逆=0.9k正,则△H____0(填“>”、“<"或“=”)。
③采用电还原法也可将CO2转化为甲酸根,用Sn为阴极、Pt为阳极,KHCO3溶液为电解液进行电解。CO2应通入______区(填“阳极”或“阴极”),其电极反应式为__________
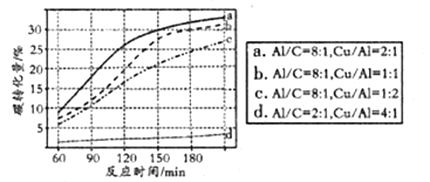
④可用NaHCO3代替CO2作为碳源加氢制备甲酸。向反应器中加入NaHCO3水溶液、A1粉、Cu粉,在300℃下反应。NaHCO3用量一定时,Al、Cu的用量对碳转化量影响结果如图。由图可知,曲线d相对其它三条曲线碳转化量变化不大的主要原因是__________,当碳转化量为30%时所采用的实验条件是____________。
 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)利用VSEPR推断分子或离子的空间构型。
PO![]() __________;CS2____________;AlBr3(共价分子)__________。
__________;CS2____________;AlBr3(共价分子)__________。
(2)有两种活性反应中间体粒子,它们的粒子中均含有1个碳原子和3个氢原子。请依据下面给出的这两种粒子的球棍模型,写出相应的化学式:
 ______;
______;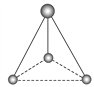 ______。
______。
(3)按要求写出第二周期非金属元素构成的中性分子的化学式。
平面三角形分子________,三角锥形分子________,四面体形分子________。
(4)为了解释和预测分子的空间构型,科学家在归纳了许多已知的分子空间构型的基础上,提出了一种十分简单的理论模型——价层电子对互斥模型。这种模型把分子分成两类:一类是____________________;另一类是____________________。BF3和NF3都是四个原子的分子,BF3的中心原子是________,NF3的中心原子是________;BF3分子的立体构型是平面三角形而NF3分子的立体构型是三角锥形的原因是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com