
科目: 来源: 题型:
【题目】乙酸是实验室常用的一种化学试剂,某乙酸试剂瓶上标签的部分内容如右图所示。利用标签提供的信息,回答下列问题:

(1)乙酸的摩尔质量为______________。
(2)若该乙酸溶液的密度为1.02g/cm3,求此乙酸溶液的物质的量浓度_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用废镍催化剂(主要成分为Ni,还含有一定量的Zn、Fe、SiO2、CaO等)制备草酸镍晶体的流程如下:
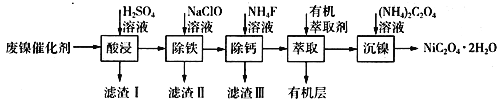
(1)请写出一种能提高“酸浸”速率的措施:________________________;滤渣I的成分是____________(填化学式)。
(2)除铁时,控制不同的条件可以得到不同的滤渣II。已知滤渣II的成分与温度、pH的关系如图所示:
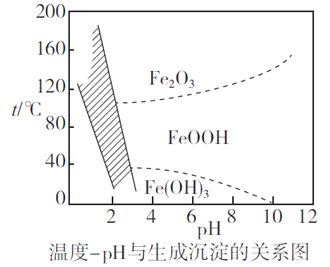
①若控制温度40℃、pH=8,则滤渣II的主要成分为_________________________(填化学式)。
②若控制温度80℃、pH=2,可得到黄铁矾钠[Na2Fe6(SO4)4(OH)12](图中阴影部分),写出生成黄铁矾钠的离子方程式:___________________________________________。
(3)已知除铁后所得100 mL溶液中c(Ca2+)=0.01mol·L-1,加入100 mL NH4F溶液,使Ca2+恰好沉淀完全即溶液中c(Ca2+)=1×10-5 mol·L-1,则所加c(NH4F)=_________mol·L-1。[已知Ksp(CaF2)=5.29×10-9]
(4)加入有机萃取剂的作用是________________________。
(5)某化学镀镍试剂的化学式为MxNi(SO4)y(M为+1价阳离子,Ni为+2价,x、y均为正整数)。为测定该镀镍试剂的组成,进行如下实验:
I.称量28.7g镀镍试剂,配制100 mL溶液A;
Ⅱ.准确量取10.00 mL溶液A,用0.40 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+),消耗EDTA标准溶液25.00mL;
Ⅲ.另取10.00 mL溶液A,加入足量的BaCl2溶液,得到白色沉淀4.66g。
①配制100 mL镀镍试剂时,需要的仪器除药匙、托盘天平、玻璃棒、烧杯、量筒、胶头滴管外,还需要________________________。
②该镀镍试剂的化学式为________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有0.27kg质量分数为10%的CuCl2溶液。试计算:
(1)溶液中CuCl2的物质的量_______;
(2)溶液中Cu2+和Cl-的物质的量_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物与人类生产、生活密切相关。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:CO(g)+NO2(g)=NO(g)+CO2(g) △H=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-b kJ·mol-1(b>0)
若用CO还原NO2至N2,当消耗标准状况下3.36L CO时,放出的热量为___________kJ(用含有a和b的代数式表示)。
(2)在373K时,向体积为2L的恒容真空容器中通入0.40 mol NO2,发生反应:2NO2(g)![]() N2O4(g) △H=-57.0 kJ·mol-1。测得NO2的体积分数[
N2O4(g) △H=-57.0 kJ·mol-1。测得NO2的体积分数[![]() (NO2)]与反应时间(t)的关系如下表:
(NO2)]与反应时间(t)的关系如下表:

①0~20 min内,v(N2O4)=________mol·L-1·min-1。
②上述反应中,v(NO2)=k1·c2(NO2),v(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时,k1、k2的数学关系式为_____________。改变温度至T1时k1=k2,则T1_________373K(填“>”、“<”或“=”)。
(3)连二次硝酸(H2N2O2)是一种二元弱酸。25℃时,向100 mL 0.1 mol·L-1H2N2O2溶液中加入V mL 0.1mol·L-1 NaOH溶液。(已知25℃时,连二次硝酸的Ka1=10-7,Ka2=10-12)
①若V=100,则所得溶液中c(H2N2O2)_____________c(N2O22-) (填“>”、“<”或“=”),通过计算解释原因____________________________________________________________。
②若V=200,则所得溶液中离子浓度由大到小的顺序为________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知电导率越大导电能力越强。常温下用0.100 mol·L-1NaOH溶液分别滴定10.00mL浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法正确的是
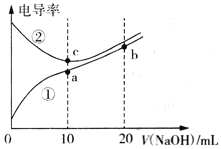
A. 曲线①代表滴定盐酸的曲线
B. 滴定醋酸的过程应该选择甲基橙作为指示剂
C. a、b、c三点溶液中水的电离程度:c>a>b
D. b点溶液中:c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0
B. 图乙表示pH相同的盐酸与氢氟酸分别加水稀释PH的变化,其中曲线a对应的是氢氟酸
C. 图丙表示该反应为放热反应,且催化剂能改变反应的焓变
D. 图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系
查看答案和解析>>
科目: 来源: 题型:
【题目】为除去粗盐中的Ca2+. Mg2+. SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
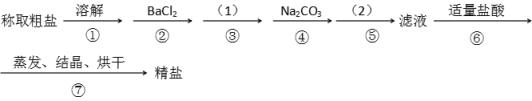
(1)第④步中,写出相应的离子方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)_______________ ;____________。
(2)实验方案的(1)中应使用除杂试剂的化学式__________,发生的离子方程式是__________,在实验方案的(2)中的操作名称是_______。
(3)从实验设计方案优化的角度分析步骤②和④可否颠倒____________(填“是”或“否”,如果“否”,请说明理由。___________________________________________;
(4)判断BaCl2已过量的方法是_________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】X和Y是原子序数大于4的短周期元素, ![]() 、
、![]() 两种离子的核外电子排布相同。下列说法中正确的是 ( )
两种离子的核外电子排布相同。下列说法中正确的是 ( )
A. X的原子半径比Y的原子半径小 B. X和Y的核电荷数之差为m -- n
C. Y原子核内所含质子数比X多 D. ![]() 半径比
半径比![]() 小
小
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组将SO2通入Na2S和Na2SO3的混合溶液中制备硫代硫酸钠(Na2S2O3)。其装置如下图所示(省略夹持装置),下列说法错误的是
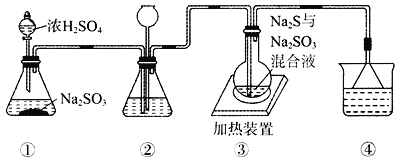
A. 装置②的作用之一是观察SO2的生成速率,其中的液体可以是饱和NaHSO3溶液
B. 为提高产品纯度,使烧瓶中Na2S和Na2SO3恰好完全反应,则![]()
C. 装置④的作用是吸收尾气,同时防止倒吸
D. 装置①也可用于高锰酸钾与浓盐酸反应制备氯气
查看答案和解析>>
科目: 来源: 题型:
【题目】写出下列物质的电离方程式。
(1)NaHCO3 _______________________________;
(2)H2SO4 _______________________________;
(3)NaOH _______________________________;
(4)NaHSO4 _______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com