
科目: 来源: 题型:
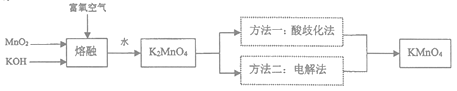
【题目】KMnO4是一种重要的氧化剂,广泛用于化学分析和化工生产以反水处理工业。工业上可由软锰矿(主要成分为MnO2)制备,目前有两种较为成熟的制法。其模拟流程如下图所示:
附表:不同温度下若干常见钾的化合物的溶解度(单位:g/(100gH2O))
化学式 | 20°C | 30°C | 40°C | 60°C | 80°C | 100°C |
CH3COOK | 256 | 283 | 324 | 350 | 381 | |
K2SO4 | 11.1 | 13 | 14.8 | 18.2 | 21.4 | 24.1 |
KCl | 34.2 | 37.2 | 40.1 | 45.8 | 51.3 | 56.3 |
KMnO4 | 6.34 | 9.03 | 12.6 | 22.1 | ||
K2CO3 | 111 | 114 | 117 | 127 | 140 | 156 |
(1)“熔融”时,可用作坩锅材质的是________________(填序号)。
A.氧化铝 B.陶瓷 C.氧化镁 D.石英
(2)写出MnO2和KOH熔融物中通入富氧空气时获得K2MnO4的化学方程式______________________。
(3)“酸歧化法”是在pH<6的情况下K2MnO4即可转化为MnO2和KMnO4,过滤除去MnO2,将滤液经过蒸发浓缩、趁热过滤得到KMnO4粗晶体,再经过重结晶获得较纯净的KMnO4晶体;
①根据表中的溶解度数据以及上述操作的特点,“酸歧化法”不适宜选择的酸性物质是________。
A.稀硫酸 B.醋酸 C.稀盐酸 D.二氧化碳
②“蒸发浓缩”时,温度需控制在70℃,适宜的加热方式是________________。
③根据相关方程式,计算“酸歧化法”的理论产率为_________________。
(4)“电解法”克服了“酸歧化法”理论产率偏低的问题,同时副产品KOH可用于软锰矿的焙烧。电解法制备高锰酸钾的实验装置示意图如下(图中阳离子交换膜只允许K+离子通过)
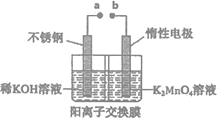
①a为______极(填“正”或“负”),右室发生的电极反应方程式为_______________。
②若电解开始时阳极区溶液为1.0L0.40mol·L-1K2MnO4溶液,电解一段时间后,右室中n(K)/m(Mn)为6:5,阴极区生成KOH的质量为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g·L-1。某兴趣小组用如图所示装置(夹持装置略)收集某葡萄酒中SO2,采用H2O2氧化法检测二氧化硫的含量,并对H2O2的催化分解原理进行分析。
已知:H2O2可看作二元弱酸,它的一级电离常数Ka1=1.55×10-12

Ⅰ.检测二氧化硫的含量
(1)仪器A的名称是_______________。
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中过量H2O2溶液充分反应,C中发生反应的化学方程式为__________________________。
(3)用0.0900mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的________(填编号)。向C中所得溶液中滴加几滴酚酞试剂,滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为_____g·L-1。
(4)该测定结果比实际值偏高,分析原用可能是_____________(任答一条即可),
(5)本实验中所用的H2O2溶液的浓度,常用KMnO4标准溶液进行测定,H2O2可看作二元弱酸,但一般不利用酸碱中和滴定法过行测定的原因_______________任答一条即可)。
Ⅱ.分析H2O2的催化分解原理
(1)碱性介质中H2O2分解远比酸性介质中快,NaOH可促使H2O2失去质子,请写出H2O2与NaOH溶液反应生成的酸式盐的电子式___________________。
(2)I-催化H2O2分解的原理分为两步,总反应可表示为:
2H2O2(aq)=2H2O(l)+O2(g) △H<0
若第一步反应为H2O2(aq)+I-(aq)=IO-(aq)+H2O(l) △H>0 慢反应
则第二步反应为____________△H <0 快反应
(3)能正确的表示I-催化H2O2分解真理的示意图为____________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g)![]() 2HI(g),1molH2完全反应放出akJ热量。
2HI(g),1molH2完全反应放出akJ热量。
已知:
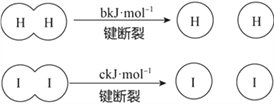 (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
A. 反应物的总能量高于生成物的总能量
B. 断开1molH-H键和1molI-I键所需能量大于断开2molH-I键所需能量
C. 断开2molH-I键所需能量约为(c+b+a)kJ
D. 向密闭容器中加入2molH2和2molI2,充分反应放出的热量大小2akJ
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生设计了如下实验:

(1)该同学的实验目的是_____________________________;
(2)上图③操作步骤为________________,④加入试剂为 ;
(3)按此实验方案得到的NaCl固体中肯定含有__________(填化学式)杂质;为了解决这个问题可以向过滤得到的滤液中加入适量的______________;
(4)写出生成C的化学方程式____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2CrO4溶液,发生的两个化学反应为SO2+2Fe3++2H2O=SO42-+2Fe2++W ①,Cr2O72-+aFe2++bH+![]() Cr3++Fe3++H2O ②,下列有关说法正确的是
Cr3++Fe3++H2O ②,下列有关说法正确的是
A. 还原性:Cr3+>SO2 B. 配平后方程式②中,a=6,b=7
C. Cr2O72-能将Na2SO3氧化成Na2SO4 D. 方程式①中W为OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用 0.100 mol·L-1 的 NaOH 溶液滴定 10.00 mL 浓度均为 0.100 mol·L-1 的盐酸和 CH3COOH 溶液。利用传感器测得滴定过程中溶液的电导 率如图所示。下列说法正确的是( )

A. 曲线①代表滴定 HCl 溶液的曲线
B. A 点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1
C. 在相同温度下,A、B、C 三点溶液中水的电离程度:C<B=A
D. D 点溶液中:c(Cl-)=2c(OH-)-2c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温时,配制一组c(Na2CO3)+c(NaHCO3)=0.100mol·L-1的混合溶液,溶液中c(CO32-)、c(HCO3-)与pH的关系如图所示。下列说法中错误的是
(己知:CO32-+H2O![]() HCO3-+OH- K=2×10-4,1g5=0.7)
HCO3-+OH- K=2×10-4,1g5=0.7)
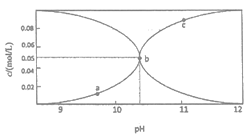
A. a点的溶液中:c(HCO3-)>c(H2CO3)+c(CO32-)
B. b点横坐标数值大约为10.3
C. c点的溶液中:c(Na+)<2c(CO32-)十c(HCO3-)
D. 溶液中水的电离程度:a<b<c
查看答案和解析>>
科目: 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v为
4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v为
A. v(O2)=0.01mol/(L·s) B. v(NO)=0.08mol/(L·s)
C. v(H2O)=0.003mol/(L·s) D. v(NH3)=0.001mol/(L·s)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度不是1 mol/L的是( )
A. 10 g NaOH固体溶解在水中配成250 mL溶液
B. 将80 g SO3溶于水并配成1 L的溶液
C. 将0.5 mol/L的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D. 标况下,将22.4 L氯化氢气体溶于水配成1 L溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以CH4为原料制备H2的原理为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。在一定条件下向a、b两个恒温恒容的密闭容器中均通入1.1molCH4(g)和1.1molH2O(g),测得两容器中CO的物质的量随时间的变化曲线分别为a和b。已知容器a的体积为10L,温度为Ta,下列说法不正确的是
CO(g)+3H2(g)。在一定条件下向a、b两个恒温恒容的密闭容器中均通入1.1molCH4(g)和1.1molH2O(g),测得两容器中CO的物质的量随时间的变化曲线分别为a和b。已知容器a的体积为10L,温度为Ta,下列说法不正确的是
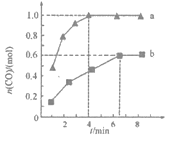
A. 容器a中CH4从反应开始到怡好平衡时的平均反应速率为0.025mol·L-1·min-1
B. a、b两容器的温度可能相同
C. 在达到平衡前,容器a的压强逐渐增大
D. 该反应在Ta温度下的平衡常数为27(mol·L-1)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com