
科目: 来源: 题型:
【题目】锌钡白是一种白色颜料,工业上由ZnSO4与BaS溶液混合而成,BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。

Ⅰ.ZnSO4溶液的制备与提纯:
有关资料:
a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;
(1)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤____(选填①、②、③或⑤)。
(2)若步骤缺少②中加入的氧化剂为H2O2,写出反应的离子方程式_____________。
(3)滤渣2中主要成分为____________________(填化学式)。
(4)写出步骤④后产生滤渣3的反应的离子方程式________________。
(5)滤液3中含碳粒子的浓度大小顺序为_____________。
Ⅱ.BaS溶液的制备

(6)写出“煅烧还原”反应的化学方程式_____________。BaSO4和BaCO3的Ksp数值接近,用平衡原理解释为什么BaCO3可溶于盐酸,而BaSO4难溶:______________。
Ⅲ.制取锌钡白
(7)如果上述工业生产流程中步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌银白产生的后果是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Fe、CO、Ni均为第Ⅷ族元素,它们的化合物在生产生活中有着广泛的应用。
(1)基态CO原子的价电子排布式为____________,Co3+核外3d能级上有_________对成对电子。
(2)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co+ 的配位数是______________,1mol 配离子中所含σ键的数目为_____________,配位体N3-中心原子杂化类型为____________________。
(3)Co2+在水溶液中以[Co(H2O)6]2+存在。向含Co2+的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+ ,其原因是___________________。
(4)某蓝色晶体中,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的某恰当位置上。据此可知该晶体的化学式为____________,立方体中Fe2+间连接起来形成的空间构型是_____________________。
(5)NiO的晶体结构如图甲所示,其中离子坐标参数A 为(0,0,0),B为(1,1,0),则C离子坐标参数为_______________。

(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为__________g(用含a、NA的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温时,向20mL0.1mol/L醋酸溶液中不断滴入0.1mol/L的NaOH溶液,溶液pH变化如图所示。下列叙述错误的是

A. a点:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B. b点:c(Na+)=c(CH3COOH)+c(CH3COO-)
C. C点:c(OH-)=c(CH3COOH)+c(H+)
D. d点:2c(Na+)=3[c(CH3COOH)+c(CH3COO-)]
查看答案和解析>>
科目: 来源: 题型:
【题目】锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为___________(用名称表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式:___________________。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是______________。
① 硫酸铝和氢氧化钠 ② 硫酸锌和氢氧化钠 ③硫酸铝和氨水 ④ 硫酸锌和氨水
(4)在火箭和导弹技术中,将铝粉与石墨、TiO2按一定比例混合均匀,涂在金属表面,在高温下煅烧,金属表面生成TiC和另一种耐高温的物质,写出该反应的化学方程式:______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空:
(1)将切开的小块钠投入到FeCl3溶液,现象是_________;反应的方程式为_____________。
(2)实验室常用还原性Fe粉与水蒸气反应的实验来研究Fe的还原性,则该反应的化学反应方程式为_____________________.
(3)分别将0.2mol的钠、镁、铝分别投入100ml 1mol·L-1的盐酸溶液中,三者产生的氢气在相同条件下的体积比为____________________。
(4)用双线桥标出电子转移的方向和数目: MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O________
MnCl2+Cl2↑+2H2O________
查看答案和解析>>
科目: 来源: 题型:
【题目】向1.0 mol/L的甲溶液中逐滴加入1.0 mol/L的乙溶液,产生Al(OH)3沉淀的质量(用y轴表示)与所加入乙溶液的体积(用x轴表示)的关系如下图所示,符合图中关系的是下列各组溶液中的( )

A | B | C | D | |
甲 | AlCl3 | NaOH | NaAlO2 | HCl |
乙 | NaOH | AlCl3 | HCl | NaAlO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】莫尔盐的化学式为( NH4)2Fe(SO4)2·6H2O,溶于水而不溶于乙醇,常被用作氧化还原滴定的基准物。下面是制取莫尔盐的部分装置与实验步骤:

①将铁屑放入小烧杯中,加适量的Na2CO3溶液,小火加热几分钟,倒掉溶液后,用蒸馏水洗净铁屑,晾干。
②在锥形瓶中加入2.24 g 铁屑和少量碳粉,由分液漏斗滴加20 mL 3 mol/L硫酸溶液。
③待反应结束后,由分液漏斗加入适量的(NH4)2SO4溶液,过滤。在滤液中加入一定量的乙醇,待晶体析出后,过滤、洗涤、晾干,得莫尔盐晶体。
请回答下列问题:
(1)实验开始前,检查反应器气密性的方法为_____________________。
(2)步骤①中Na2CO3溶液的作用是_____________________________________。
(3)步骤②中滴加硫酸溶液时留取少许溶液于分液漏斗中的原因是__________________,加入少量碳粉的作用是_________________________________________。
(4)步骤③中理论上需加入2 mol/L 的(NH4)2SO4溶液______________mL。
(5)取10.00 g铬青铜样品,将其中的铬氧化为H2CrO4,再加入硫酸酸化,并配成250mL溶液,取出25.00 mL用浓度为0.0180 mol/L的(NH4)2Fe(SO4)2标准溶液滴定,终点时用去标准液20.75 mL。已知弱酸H2CrO4被还原为Cr3+,则滴定时反应的离子方程式为_____________________________________。该样品中铬元素的质量分数为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 作为一种重要的化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究着被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
作为一种重要的化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究着被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
反应Ⅰ:![]()
![]()
![]() △H=
△H=![]()
反应Ⅱ:![]()
![]()
![]()
![]()
(1)在恒温恒容装置中充入一定量的![]() 和
和![]() ,在某催化剂的作用下进行反应I,则下列有关叙述中正确的是___________________。
,在某催化剂的作用下进行反应I,则下列有关叙述中正确的是___________________。
A. 使用催化剂时,可降低该反应的活化能,加快其反应速率
B. 若测得容器内![]() 时,说明反应已达平衡
时,说明反应已达平衡
C. 当容器内![]() 时,说明反应已达平衡
时,说明反应已达平衡
D. 当测得容器内氧气浓度不再变化时,说明反应已达达平衡
(2)氨催化氧化时会发生上述两个竞争反应Ⅰ、Ⅱ。为分析某催化剂对该反应的选择性,1L密闭容器中充入1 mol ![]() 和2 mol
和2 mol ![]() ,测得有关物质的量关系如图
,测得有关物质的量关系如图
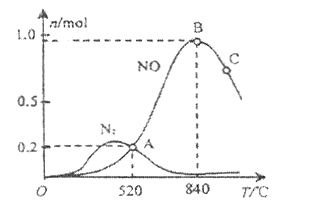
①该催化剂在高温时选择反应_______________(填“Ⅰ”或“Ⅱ”)。
②520℃时, ![]()
![]()
![]() 的平衡常数K表达式________。
的平衡常数K表达式________。
③有利于提高![]() 转化为
转化为![]() 的速率的措施有_________________。
的速率的措施有_________________。
A. 使用催化剂![]()
B. 将反应生成的![]() 及时移出
及时移出
C. 充入稀有气体
D. 投料比不变,增加反应物的浓度
E. 降低反应温度
(3)最近华南理工大提出利用电解法制![]() 并用产生的
并用产生的![]() 处理废氨水,装置如图
处理废氨水,装置如图
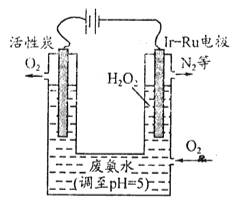
①为了不影响![]() 的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)_________c(NO3-)(填>、=、<)。
的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)_________c(NO3-)(填>、=、<)。
②Ir-Ru惰性电极有吸附![]() 作用,该电极上产生
作用,该电极上产生![]() 的反应为_________,生成的
的反应为_________,生成的![]() 与废液反应的离子方程式为_________________。
与废液反应的离子方程式为_________________。
③理论上电路中每转移3 mol电子,最多可以处理![]() 的物质的量为__________。
的物质的量为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com