
科目: 来源: 题型:
【题目】下列反应中,水既不是氧化剂,也不是还原剂,但反应是氧化还原反应的是( )
A. Na2O+H2O=2NaOH B. Cl2+H2O=HCl+HClO
C. C+H2O=CO+H2 D. 2F2+2H2O=4HF+O2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子中,在碱性溶液里能大量共存,并且溶液为无色透明的是( )
A.K+ MnO4- Cl- SO42-B.Na+ K+ Al3+ Ba2+
C.Na+ HCO3- NO3- SO42-D.Na+ SO42- S2- Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】在FeCl3、CuCl2和HCl的混合溶液中加入铁粉,待反应结束,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是( )
A.Fe3+B.Fe2+C.H+D.Cu2+
查看答案和解析>>
科目: 来源: 题型:
【题目】制备硅单质时,主要化学反应如下:
(1)SiO2+2C![]() Si+2CO↑
Si+2CO↑
(2)Si+2Cl2![]() SiCl4
SiCl4
(3)SiCl4+2H2![]() Si+4HCl
Si+4HCl
下列对上述三个反应的叙述中,不正确的是( )
A. (1)(3)为置换反应 B. (1)(2)(3)均为氧化还原反应
C. (2)为化合反应 D. 三个反应的反应物中硅元素均被还原
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学用如下装置进行实验①和②,在相同时间内,记录现象如下(溶液的温度变化均不明显)。
实验装置 | 实验序号 | 电极材料 | 实验现象 |
| ① | 铂 | 两极均产生大量无色气泡, 两极区的溶液均未见白色浑浊 |
② | 石墨 | 两极均产生大量无色气泡, 阴极区未见白色浑浊, 阳极区产生白色浑浊,分离出该白色固体,加酸溶解,产生气泡 |
根据实验现象,下列说法正确的是
A. ①②中,阴极的电极反应式:2H2O-4e == O2↑+ 4H+
B. ②中,白色浑浊的主要成分是Ca(OH)2
C. ②中,产生白色浑浊的主要原因是电解过程消耗水
D. ②中,产生白色浑浊与阳极材料被氧化生成CO32有关
查看答案和解析>>
科目: 来源: 题型:
【题目】饮用水质量是关系人类健康的重要问题。
(1)在我国,一些贫困山区的农民至今还饮用井水,但暴雨过后井水混浊,无法饮用。为了能让暴雨过后井水尽快变的澄清,你会建议他们最好向井水中投入下列中的___(填序号)。
A.NaCl B.Na2CO3 C.Kal(SO4)2·12H2O D.CuSO4
(2)氯气是最早用于饮用水消毒的物质,其消毒作用主要是氯气溶于水后生成了次氯酸,该反应的离子方程式为:____________________________
(3)写出工业上制取漂白粉的化学方程式:__________________
(4)臭氧,也称作超氧,可以替代氯气给自来水消毒,即提高了消毒效率且安全无副作用,臭氧的分子式为O3,该物质和次氯酸均可以做漂白剂,二者的漂白原理是:_______________。
(5)某化学活动小组设计实验(装置如图)验证氯、溴、碘及其化合物的有关物质。在硬质玻璃管中的A、B、C三处依次放置湿润的蓝色石蕊试纸、浸有NaBr溶液的棉球、浸有淀粉-KI溶液的棉球(如图所示),由左端通入足量氯气,回答下列问题:
![]()
①观察到的现象
A:__________________;B:__________________;C:__________________
②由上述现象得出的结论氧化性:Cl2 > Br2 > I2,你认为正确吗,为什么? ______________;___________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】铝用途广泛,用铝土矿(主要成分为Al2O3·nH2O、少量SiO2和Fe2O3)制取Al有如下途径:
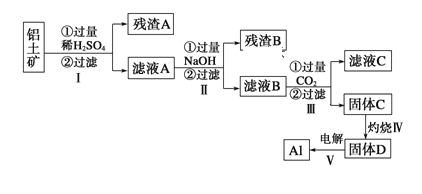
(1)滤液A加过量NaOH离子方程式表示为______________________________
(2)灼烧时盛放药品的仪器名称是_______
(3)步骤Ⅳ中发生反应的化学方程式是___________________________________
(4)步骤Ⅲ中生成固体C的离子反应方程式为_____________________________
(5)取滤液B 100mL,加入1 mol/L盐酸200 mL,沉淀量达到最大且质量为11.7g,则滤液B中c(AlO2-)____mol/L,c(Na+)____6 mol/L (填“大于”、“小于”或“等于”)
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度时,Cu2+,Mn2+、Fe2+、Zn2+等四种金属离子(M2+)形成硫化物沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示。下列有关判断不正确的是
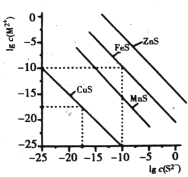
A. 该温度下,Ksp(MnS)大于1.0×10-15
B. 该温度下,溶解度:CuS>MnS>FeS>ZnS
C. 向含Mn2+、Zn2+的稀溶液中滴加Na2S溶液,Mn2+最有可能先沉淀
D. 向c(Fe2+)=0.1mol/L的溶液中加入CuS粉末,有FeS沉淀析出
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)配平该方程式__KMnO4+__HCl (浓) =__KCl+__MnCl2+__Cl2↑+__H2O
(2)反应中(1)中____是还原剂,_____是还原产物 .
(3)该反应的离子方程式为:_______________________
(4)用双线桥法分析此氧化还原反应____________________________
(5)NA表示阿伏伽德罗常数,若产生标准状况下的气体的体积为2.24L ,则反应过程中转移电子的数目为_________,被氧化的HCl的质量为_____g
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计下列方法对A盐的水溶液进行鉴定:
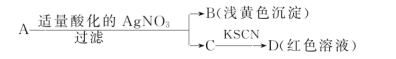
由此得出的结论中,不正确的是
A.D溶液中存在Fe(SCN)3 B.滤液C中有Fe3+
C.B为AgBr D.A一定是FeBr2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com