
科目: 来源: 题型:
【题目】有关NaHCO3和Na2CO3的下列叙述中错误的是( )
①等质量的NaHCO3和Na2CO3分别与足量盐酸反应,Na2CO3产生的CO2多
②84 g NaHCO3、106 g Na2CO3分别与足量的盐酸完全反应,Na2CO3消耗盐酸的物质的量是NaHCO3的两倍
③将澄清石灰水分别倒入两种盐溶液中,只有Na2CO3溶液中产生白色沉淀
④通常状况下,相同温度下,Na2CO3的溶解度大于NaHCO3
A. ①② B. ②③ C. ②④ D. ①③
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组在实验室利用氨气和新制备的硫酸亚铁溶液反应制备氢氧化亚铁。
(一)制备硫酸亚铁溶液

(1)步骤①,加入稀硫酸的目的是_______。
(2)步骤②,加入还原铁粉后观察到的现象是_______。
(二)制备氢氧化亚铁

(3)选择上图中的装置制备氢氧化亚铁,连接顺序为_______(按气流方向,用装置字母表示)。反应结束后继续通一段时间的N2,目的是_______。
(4)装置B中发生反应的离子方程式是_______。装置C的作用是_______。
(三)探究思考
反应后将装置B中固体过滤时白色沉淀会逐渐转变为灰绿色。在查阅不同资料后,有同学认为灰绿色物质是Fe(OH)2被空气中的氧气氧化后生成的Fe3(OH)8。
(5)Fe3(OH)8中n(Fe2+):n(Fe3+) =_______,用氧化物的形式表示可写成_______。
(6)设计实验证明灰绿色物质中含Fe3(OH)8:_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子能大量共存的是
A. pH=12的溶液中:K+、Na+、Br-、![]()
B. 无色溶液中:H+、K+、![]() 、
、![]()
C. c(Fe3+)=0.1mol·L-1的溶液中:K+、H+、SCN-、I-
D. 由水电离出的c(OH-)=1.0×10-13mol·L-1的溶液中:Na+、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下图表示的一些物质或概念间的从属关系中正确的是
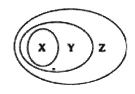
X | Y | Z | |
A | 过氧化钠 | 碱性氧化物 | 氧化物 |
B | 硫酸 | 化合物 | 电解质 |
C | 淀粉溶液 | 胶体 | 分散系 |
D | 置换反应 | 氧化还原反应 | 离子反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】中国是最早发现并使用青铜器的国家。司母戊鼎是迄今为止出土的世界上最大、最重的青铜礼器,享有“镇国之宝”的美誉(如图1)。

(1)Cu原子的外围电子排布式为_______。
(2)图2所示为第四周期某主族元素的第一至五电离能数据,该元素是_______,I3远大于I2的原因是_______。
(3)图3是某含铜配合物的晶体结构示意图。
①晶体中H2O和SO42-的中心原子的杂化类型为_______,试判断H2O和SO42-的键角大小关系并说明原因_______。
②图3中的氢键有(H2O)O—H···O(H2O)和_______。
③写出该配合物的化学式_______。
(4)一种铜的氯化物晶胞结构如下图所示。

该化合物的化学式为_______,已知P、Q、R的原子坐标分别(0,0,0)、(1,1,1)、 (![]() ,
,![]() ,
,![]() ),若Cu原子与最近的Cl原子的核间距为a pm,则该晶体的密度计算表达式为_______。
),若Cu原子与最近的Cl原子的核间距为a pm,则该晶体的密度计算表达式为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】共价键、离子键和范德华力都是微观粒子之间的不同作用力,下列物质:①Na2O2;②SiO2;③碘;④金刚石;⑤NaCl;⑥白磷,其中含有两种作用力的组合是
A.①②⑤B.①③⑥C.②④⑥D.①②③⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】NOx是造成大气污染的主要物质,用还原法将其转化为无污染的物质,对于消除环境污染有重要意义。
(1)已知:2C(s)+O2(g)![]() 2CO(g) △H1= -221.0 kJ/mol
2CO(g) △H1= -221.0 kJ/mol
N2(g)+O2(g)![]() 2NO (g) △H2= +180.5 kJ/mol
2NO (g) △H2= +180.5 kJ/mol
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H3= -746.0 kJ/mol
2CO2(g)+N2(g) △H3= -746.0 kJ/mol
回答下列问题:
①用焦炭还原NO生成无污染气体的热化学方程式为_______。
②在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中c(NO)(mol/L)随时间(s)的变化如下表。
已知:三个容器的反应温度分别为T甲= 400℃、T乙= 400℃、T丙= a ℃
时间 | 0 s | 10 s | 20 s | 30 s | 40 s |
甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
丙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
甲容器中,该反应的平衡常数K=_______。丙容器的反应温度a _______400℃(填“”、“<”或“=”),理由是_______。
(2)用NH3催化还原NOx消除氮氧化物的污染。
已知:8NH3(g)+6NO2(g)![]() 7N2(g) +12H2O(l) △H<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。
7N2(g) +12H2O(l) △H<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。

①在催化剂A的作用下,0~4 min的v(NH3) = _______。
②该反应活化能Ea(A)、Ea(B)、Ea(C)由大到小的顺序是_______,理由是_______。
③下列说法正确的是_______(填标号)。
a.使用催化剂A达平衡时,△H值更大
b.升高温度可使容器内气体颜色加深
c.单位时间内形成N-H键与O-H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡
查看答案和解析>>
科目: 来源: 题型:
【题目】利用废旧锂离子电池的正极材料(主要成分为LiCoO2、Al以及少量Ca、Mg、Cu、Fe等)制备Co3O4微球的工艺流程如下:
回答下列问题:
(1)LiCoO2 中Co元素的化合价为_______。
(2)步骤①中生成Co2+的离子方程式为_______。此过程中若用浓盐酸代替H2SO4和H2O2的混合溶液,除因挥发使其利用率降低外,还有的缺点是_______。
(3)步骤②中,不同pH下溶液中金属离子的去除效果如下图所示。该过程加入NaOH调节溶液pH的最佳范围是_______,理由是_______。

(4)步骤④中,过滤、洗涤操作均需用到的玻璃仪器有烧杯、玻璃棒、_______。
(5)步骤⑤中,Co(OH)2在空气中高温焙烧生成Co3O4的化学方程式为_______。
(6)若以钴为电极,控制一定条件,电解NaCl溶液也可制取Co3O4的前驱体Co(OH)2。写出电解的总反应方程式_______。
(7)实验室测得“浸出液”中钴元素的含量为a mg/L,取20 mL“浸出液”模拟上述流程进行实验,得到“Co3O4微球”产品b g,又测得产品中钴元素的质量分数为w%。计算钴的回收率为_______(列式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.00mL于锥形瓶中,加入10.00mL的KI溶液(足量),发生的反应为:Cl2+2KI=2KCl+I2,滴入指示剂2~3滴。
②取一滴定管依次用自来水、蒸馏水洗净后,马上注入0.01mol/L溶液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+2Na2S4O6。
试回答下列问题:
(1)步骤①加入的指示剂是_____________。
(2)步骤②应使用______式滴定管。
(3)判断达到滴定终点的实验现象是_____________。
(4)用0.1032mol/LHCl溶液滴定未知浓度的NaOH溶液,下列情况对实验结果无影响的是___(填标号)。
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.滴定滴定管尖嘴中有气泡,滴定后气泡消失了
D.滴定时将标准液溅出锥形瓶外
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com