
科目: 来源: 题型:
【题目】某学生利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.

请回答下列问题:
(1)装置F中发生反应的离子方程式为_________________________.(提示,高锰酸钾的还原产物为Mn2+)
(2)盛放浓盐酸的装置的名称是___________;A装置中的固体可能是____________.
(3)通入C装置的两根导管左边较长、右边较短,目的是________________________.
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.请写出反应的化学方程式:__________________________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】写出下表中各物质加横线元素的化合价:
物质 | NH3 | H2O2 | O2 | HClO | SO2 |
化合价 | ________ | ________ | _____ | ________ | ________ |
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)现有下列物质:①铁单质 ②二氧化碳 ③氯气 ④硫酸钡晶体 ⑤碳酸氢钠 ⑥盐酸 ⑦氢氧化钠溶液 ⑧乙醇 ⑨熔化的硝酸钾
属于电解质的是___________________(填序号)
(2)请写出下列反应的离子方程式:
⑤与⑦反应:____________________________________________;过量②与⑦反应:_________________________________________
(3)实验室可用下列反应原理制备氯气:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O。在该反应中,被还原的物质是__________(填化学式);若反应中生成了4.48L Cl2 (标准状况),则被氧化的HCl为___________mol。
MnCl2+Cl2↑+2H2O。在该反应中,被还原的物质是__________(填化学式);若反应中生成了4.48L Cl2 (标准状况),则被氧化的HCl为___________mol。
(4)工业废水含有Cu2+ 、Ba2+ 、Ag+要求加入三种试剂,每次只沉淀一种离子,写出加入第一种试剂时,所发生反应的离子方程式____________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】资料显示:久置于潮湿环境中的漂白粉受热生成O2和少量Cl2;干燥的漂白粉加热后发生反应Ca(ClO)2![]() CaCl2 + O2↑。
CaCl2 + O2↑。
学生甲利用下图装置进行实验:加热A中试管内装有的潮湿漂白粉样品时,观察到B中有大量气泡产生。
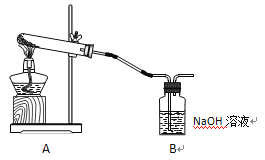
(1)B中发生反应的离子方程式为__________________________________________________。
(2)请写出实验室检验氯气的方法:_____________________________________________。
学生乙设计实验测定某干燥漂白粉样品中次氯酸钙的百分含量。实验步骤如下:
①称量坩埚的质量,为W1g。
②坩埚中加入样品后再称,质量为W2g。
③重复进行加热、冷却、称量,直到恒重,质量为W3g。
(3)称量所用仪器名称为_____________________;实验到达恒重的判断依据是___________________________________________________。
(4)该漂白粉样品中次氯酸钙的百分含量为_________________(用W1、W2、W3表示);若所用坩埚内壁沾有受热易分解的物质,则该实验测得的结果__________________。(选填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目: 来源: 题型:
【题目】根据实验室制NH3的反应原理和实验装置,回答下列问题。
(1)写出加热NH4Cl和Ca(OH)2制取NH3的化学方程式:______________________。
(2)若要得到干燥的NH3,合适的干燥剂为_________(填选项编号,下同)
a.浓硫酸 b.碱石灰 c.无水CaCl2 d.P2O5
(3)下列气体能用排水法收集的是____,能用向上排空气法收集的是____。
a.NH3 b.NO c.NO2 d.SO2
(4)NH3易溶于水,难溶于有机溶剂CCl4。下列图示装置中,可以做NH3的尾气吸收装置的是___________。

(5)如何检验氨气已收集满试管?____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在不同温度下,向2L密闭容器中加入1molNO和1mol活性炭,发生反应: ![]() H=-213.5kJ/mol,达到平衡时的数据如下:
H=-213.5kJ/mol,达到平衡时的数据如下:
温度/℃ | n(活性炭)/mol | n(CO2)/mol |
T1 | 0.70 | —— |
T2 | —— | 0.25 |
下列说法不正确的是
A. 上述信息可推知:T12
B. T1℃时,该反应的平衡常数K=9/16
C. T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)不变
D. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
查看答案和解析>>
科目: 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段.如图是硫元素的常见化合价与部分物质类别的对应关系:

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______(填化学式).
(2)将X与Y混合,可生成淡黄色固体.该反应中氧化剂与还原剂的物质的量之比为_______.
(3)检验物质Y的方法是_______________________________.
(4)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______.
(5)Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是______(填代号).
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)已知Na2SO3能被K2Cr207氧化为Na2SO4则24mL 0.05molL﹣1的Na2SO3溶液与 20mL 0.02molL﹣1的溶液恰好反应时,Cr元素在还原产物中的化合价为________.
查看答案和解析>>
科目: 来源: 题型:
【题目】杨梅醛是常用的水果型食用香精,其合成路线如下:
已知:(CH3CO)2O是乙酸酐,也可写成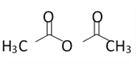 。
。
请回答下列问题:
(1)写出反应类型:①________;③________。
(2)写出反应②的化学方程式:_______________________。
(3)写出两种符合下列条件的![]() 的同分异构体:______。
的同分异构体:______。
i. 含有苯环 ii. 含有醛基:
(4)以下是检验ClCH2COOH中氯元素的实验方案,请把它补充完整。
取少量ClCH2COOH置于试管中,________,加热,_________________,滴加硝酸银溶液,观察是否产生白色沉淀。
(5)根据上述合成路线,设计以CH3COOH和![]() 为原料制备
为原料制备 的合成路线(其它试剂任选)_______。
的合成路线(其它试剂任选)_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】用氢氧燃料电池电解苦卤水(苦卤水含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b均为石墨电极),下列有关说法正确的是
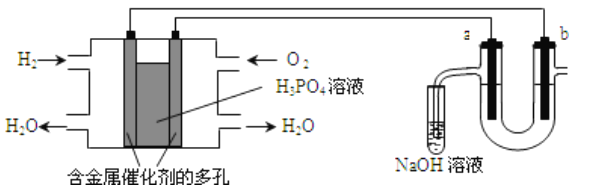
A. 燃料电池工作时,正极反应为:O2+4H++2e-===2H2O
B. 电解时,电子流动的路径是:负极→外电路→阴极→溶液→阳极→正极
C. 忽略能量损耗,当电池中消耗1.12LO2(标准状况)时,b极周围会产生0.1gH2
D. 电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,水的电离达到平衡: ![]() ,下列叙述正确的是
,下列叙述正确的是
A. 将水加热,Kw增大,pH不变
B. 向水中加入少量盐酸,c(H+)增大,Kw不变
C. 向水中加入NaOH固体,平衡逆向移动,c(OH-)降低
D. 向水中加入AlCl3固体,平衡正向移动,c(OH-)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com