
科目: 来源: 题型:
【题目】研究氮的氧化物具有重要意义。回答下列问题:
(1)2016年10月19日“天宫二号”与“神舟十一号”顺利实现太空交会对接。运载火箭用的是一种叫肼(N2H4)的燃料和氧化剂NO2,两者反应生成氮气和气态水。
已知: N2 (g) + 2O2 (g) = 2NO2 (g) △H = +67.7 kJ·mol-1
N2 H4 (g) +O2 (g) = N2 (g) +2H2 O (g) △H =-543 kJ·mol-1
①写出肼和NO2反应的热化学方程式__________________________________。
②若已知: 2H2(g)+O2(g)=2H2O(g) ΔH1=-Q1 kJ·mol-1;
2H2(g)+O2(g)=2H2O(l) ΔH2=-Q2 kJ·mol-1,
则 Q1_________Q2(填“>”“<”或“=”)。
(2)汽车尾气净化器中发生的反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。一定条件下,在三个体积均为1.0 L恒容密闭容器中发生上述反应,测得有关实验数据如下:
N2(g)+2CO2(g)。一定条件下,在三个体积均为1.0 L恒容密闭容器中发生上述反应,测得有关实验数据如下:
容器 | 温度/(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | ||||
NO | CO | N2 | CO2 | N2 | CO2 | ||
I | 400 | 0.2 | 0.2 | 0 | 0 |
| 0.12 |
II | 400 | 0.4 | 0.4 | 0 | 0 |
| x |
III | 300 | 0 | 0 | 0.1 | 0.2 | 0.075 |
|
①容器I中达到平衡所需时间2 s,则v(N2)=_______;
②x_____0.24(填“>”、“=”、“<”);△H_____0 (填“>”、“=”、“<”);
③若起始时向I中充入NO、CO各0.1 mol,N2、CO2各0.0 5 mol,开始时v(正)
___ v(逆) (填“>”、“=”、“<”)。
(3)SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
①SCR(选择性催化还原)工作原理:
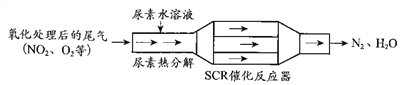
尿素溶液浓度影响NO2的转化,控制尿素的浓度非常关键。测定溶液中尿素(M=60 g·mol 1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的V1 mL c1 mol·L1 H2SO4溶液吸收完全,剩余H2SO4用V2 mL c2 mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是________________________。
②NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示。

通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是_______;
用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式__________。
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:
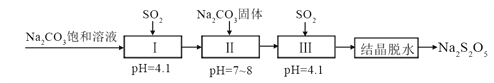
①pH=4.1时,Ⅰ中为__________溶液(写化学式)。
②工艺中加入Na2CO3固体、并再次充入SO2的目的是__________。
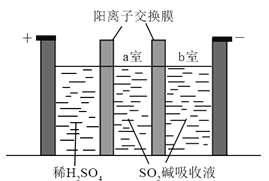
(3)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为_____________。电解后,__________室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。
(4)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.01000 mol·L1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为_____________,该样品中Na2S2O5的残留量为____________g·L1(以SO2计)。
查看答案和解析>>
科目: 来源: 题型:
【题目】证明浓HNO3的氧化性比浓H2SO4的氧化性强的事实是
A.浓硝酸加热能放出氧气
B.浓HNO3跟浓盐酸可配制成王水
C.HNO3跟金属反应可生成价态不同的氧化物
D.浓HNO3跟铜剧烈反应且不需加热
查看答案和解析>>
科目: 来源: 题型:
【题目】电化学应用广泛。请回答下列问题:
(1)自发进行的氧化还原反应可以设计成原电池。若电池放电时的反应式为:2Cu+2H2SO4+O2= 2CuSO4+2H2O,该电池的负极材料为_________;正极的电极反应式为__________________。
(2)燃料电池和二次电池的应用非常广泛。
①如图为甲烷燃料电池的示意图,电池工作时,b极的电极名称为_______;负极的电极反应式为____________;

②铅蓄电池为生活中常用的二次电池。放电时的反应为:PbO2 + Pb+ 2H2SO4 === PbSO4 + 2H2O,铅蓄电池负极的电极反应式为__________;充电时,铅蓄电池的PbO2极应与外加直流电源的__极相连,PbO2极的电极反应式为_________。
(3)以铅蓄电池为电源精炼粗铜(含Fe、Pb、Ag、Au及其他不反应质)时,以硫酸铜溶液为电解质溶液,粗铜做_____极;精炼一段时间后,当阴极增重128 g时,铅蓄电池参加反应的硫酸的物质的量为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸渣的主要化学成分为SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。下列为以硫酸渣为原料制取铁红氧化铁的工业流程图:

回答下列问题:
(1)有毒气体的化学式可能是___________;
(2)净化的操作是为了除去滤液中的Al3+。
①为调节溶液的pH,加入的物质X为_______________;
②若要准确测定溶液的pH,下列物品中可供使用的是_______(填标号)。
A.石蕊试液 B.广泛pH试纸 C.精密pH试纸 D.pH计
③若常温时KSP[Al(OH)3]=8.0×10-32,此时理论上将Al3+离子沉淀完全(离子浓度小于1.0×10-5),溶液的pH为___________________________。
(3)验证FeCO3洗涤干净的实验为____________________________。
(4)工业生产中将煅烧所得的氧化铁与KNO3、KOH固体加热共熔制备净水剂K2FeO4,同时获得一种亚硝酸盐,反应的化学方程式为:_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:

①EDTA-Fe2+-e-=EDTA-Fe3+
②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+
该装置工作时,下列叙述错误的是
A. 阴极的电极反应:CO2+2H++2e-=CO+H2O
B. 协同转化总反应:CO2+H2S=CO+H2O+S
C. 石墨烯上的电势比ZnO@石墨烯上的低
D. 若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需为酸性
查看答案和解析>>
科目: 来源: 题型:
【题目】在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一致且正确的是( )
A. 加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B. 溶液呈浅黄绿色,且有刺激性气味,说明有Cl2分子存在
C. 用盐酸酸化后,滴入AgNO3溶液产生白色沉淀,说明氯水中有Cl-存在
D. 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
查看答案和解析>>
科目: 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目: 来源: 题型:
【题目】已知pAg+= -lgc(Ag+),pX-= -lgc(X-)。某温度下,AgBr、AgI在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是

A. a和c两点的KW相同
B. KSP(AgCl)=1.0×10-14 mol2·L-2
C. 向饱和AgCl溶液中加入NaCl固体,可使a点变到d点
D. AgCl(s)+Br-(aq)![]() AgBr (s)+Cl-(aq)平衡常数K= KSP(AgCl)/ KSP(AgBr)
AgBr (s)+Cl-(aq)平衡常数K= KSP(AgCl)/ KSP(AgBr)
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下,将a L HCl完全溶于水得到V mL盐酸,溶液的密度为ρ g·cm-3,溶质的质量分数为w,溶质的物质的量浓度为c mol·L-1。下列叙述中正确的是
①c=![]() ×100% ②c=
×100% ②c=![]() ③若上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w ④将50 g上述溶液加入一定量的水稀释成0.5c mol·L-1,则加入水的体积应大于50 mL
③若上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w ④将50 g上述溶液加入一定量的水稀释成0.5c mol·L-1,则加入水的体积应大于50 mL
A. ①④ B. ②③
C. ①③ D. ②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com